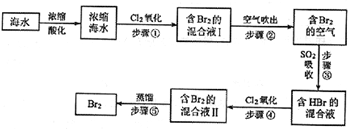
题目内容
12.已知X、Y、Z、W四种短周期元素的原子序数依次增大,Y的核电荷数是X、W核电荷数之和的2/3;X能分别与Y、Z、W形成常见的电子总数相等的分子甲、乙、丙.请回答:(1)丙常温下不是气体,主要原因是水分子之间存在氢键.
(2)化合物Y2X2的电子式为
 .
.(3)乙与Z的最高正价氧化物的水化物刚好完全反应时,其生成物的水溶液呈酸性,其原因是(用离子方程式表示)NH4++H2O?NH3•H2O+H+,其中,粒子浓度存在着如下关系:
c(H+)=c(OH-)+c(NH3•H2O).
(4)用甲、NaOH溶液和惰性电极,可设计为一种燃料电池.则该燃料电池的
负极反应为CH4-8e-+10OH-═CO32-+7H2O;
正极反应为2O2+8e-+4H2O═8OH-.
分析 X、Y、Z、W四种短周期元素的原子序数依次增大,Y的核电荷数是X、Z核电荷数之和的$\frac{2}{3}$倍,结合原子序数可知,Y处于第二周期,且处于偶数族,X能分别与Y、Z、W形成电子总数相等的分子甲、乙、丙,考虑为氢化物,X为H元素,可推知Y为C元素、Z为N元素,W为O元素,甲、乙、丙分别为CH4、NH3、H2O,验证符合题意.
(1)水分子之间存在氢键,常温下为液态;
(2)化合物Y2X2为C2H2,C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对;
(3)所得溶液为硝酸铵溶液,溶液中NH4+水解,破坏水的电离平衡溶液呈酸性;
液中氢离子来源于水的电离、NH4+水解,根据质子恒等式解答;
(4)负极发生氧化反应,CH4在负极失去电子,碱性条件下生成碳酸根、H2O,正极发生还原反应氧气在正极获得电子,碱性条件下生成氢氧根离子.
解答 解:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的核电荷数是X、Z核电荷数之和的$\frac{2}{3}$倍,结合原子序数可知,Y处于第二周期,且处于偶数族,X能分别与Y、Z、W形成电子总数相等的分子甲、乙、丙,考虑为氢化物,X为H元素,可推知Y为C元素、Z为N元素,W为O元素,甲、乙、丙分别为CH4、NH3、H2O,验证符合题意.
(1)水分子之间存在氢键,常温为液态,
故答案为:水分子之间存在氢键;
(2)化合物Y2X2为C2H2,C原子之间形成三对共用电子对,C原子与H原子之间形成1对共用电子对,其电子式为: ,
,
故答案为: ;
;
(3)乙为氨气,Z的最高正价氧化物的水化物为硝酸,二者刚好完全反应所得溶液为硝酸铵溶液,溶液中NH4+水解NH4++H2O?NH3•H2O+H+,破坏水的电离平衡溶液呈酸性;
溶液中氢离子来源于水的电离、NH4+水解,根据质子恒等式,可知c(H+)=c(OH-)+c(NH3•H2O),
故答案为:NH4++H2O?NH3•H2O+H+;c(NH3•H2O);
(4)负极发生氧化反应,CH4在负极失去电子,碱性条件下生成碳酸根、H2O,负极电极反应式为:CH4-8e-+10OH-═CO32-+7H2O,
正极发生还原反应氧气在正极获得电子,碱性条件下生成氢氧根离子,正极电极反应式为;2O2+8e-+4H2O═8OH-,
故答案为:CH4-8e-+10OH-═CO32-+7H2O;2O2+8e-+4H2O═8OH-.
点评 本题考查元素化合物推断、盐类水解、溶液离子浓度比较、原电池等,题目比较综合,推断元素是解题关键,本题难点是元素的推断,需要学生熟练掌握基础知识,难度中等.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
| A. | 某温度时,化学反应速率无论用哪种物质表示,其数值是相等的 | |
| B. | 其他条件不变,降低温度,反应速率减慢 | |
| C. | 其他条件不变时,增大压强,化学反应速率一定加快 | |
| D. | 若增加或减少A的物质的量,反应速率一定会发生明显的变化 |
 诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )
诺龙属于国际奥委会明确规定的违禁药物中的合成代谢类类固醇,其结构简式如图所示.下列关于诺龙性质的说法中不正确的是( )| A. | 能与氢气反应 | B. | 能与金属钠反应 | ||
| C. | 能与NaOH溶液反应 | D. | 不能与新制Cu(OH)2悬浊液反应 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 乙烯和聚乙烯都可以发生加成反应 | |
| B. | 甲苯分子中的所有碳原子共平面,聚乙烯分子中的所有碳原子共直线 | |
| C. | 乙酸乙酯、油脂分别在NaOH溶液中反应都有醇生成 | |
| D. | Ba2+中毒,可以吃煮熟的鸡蛋解毒 |
| A. | 由于生石灰与水产生的氢氧化钙显碱性,可以使病毒蛋白失去活性 | |
| B. | 饱和石灰水中加入生石灰,在温度不变的情况下,pH不变 | |
| C. | 饱和石灰水中加入生石灰,在温度不变的情况下,溶液中Ca2+的物质的量不变 | |
| D. | 给饱和石灰水溶液升高温度,c(OH-)的浓度降低 |
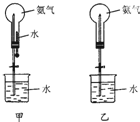 制取氨气并完成喷泉实验(图中夹持装置均以略去)
制取氨气并完成喷泉实验(图中夹持装置均以略去)(1)写出实验室制取氨气的化学方程式:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)收集氨气使用向下排空气方法,要得到干燥的氨气可选用碱石灰做干燥剂.
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是打开止水夹,挤出胶头滴管中的水.该实验的原理是氨气极易溶解于水,致使烧瓶内气体压强迅速减小.
(4)如果只提供乙图装置,请设计引发喷泉的方法打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)现将甲中的NH3和水换成下列气体和液体,不能全部充入上述装置中的选项是,并说明理由(可不填满):
| 气体 | 液体 | |
| A | NO2 | 水 |
| B | CO2 | 4mol•L-1NaOH溶液 |
| C | Cl2 | 饱和NaCl溶液 |
| D | NH3 | 1mol•L-1盐酸 |
②选项是C,理由是氯气不溶于饱和氯化钠溶液;
③选项是.,理由是.;
④选项是.,理由是..