题目内容
2.有机物A是烃的含氧衍生物,1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g;若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g;取4.6gA与足量的金属钠反应,生成的气体在标准状况下的体积为1.68L;A不与纯碱反应.该有机物的质谱图中质荷比的最大值是92.通过计算确定A的分子式和结构简式.分析 有机物A是烃的含氧衍生物,在同温同压下,A蒸气与乙醇蒸气的相对密度是2,则A的相对分子质量为92,1.38gA完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g为二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g为水的质量,故二氧化碳质量为3.06g-1.08g=1.98g,根据原子守恒计算有机物A中C、H原子数目,再结合A的相对分子质量计算分子中O原子数目,据此确定有机物A的分子式;
取4.6gA的物质的量为0.05mol,与足量的金属钠反应,生成的气体在标准状况下的体积为1.68L,即氢气的物质的量为:$\frac{1.68L}{22.4L/mol}$=0.075mol,A不与纯碱反应,则A没有-COOH,故有机物含有-OH,羟基数目=$\frac{0.075mol×2}{0.05mol}$=3,据此进行解答.
解答 解:有机物A是烃的含氧衍生物,在同温同压下,A蒸气与乙醇蒸气的相对密度是2,则A的相对分子质量为92,
1.38gA的物质的量为:$\frac{1.38g}{92g/mol}$=0.015mol,完全燃烧后,若将燃烧的产物通过碱石灰,碱石灰的质量会增加3.06g为二氧化碳、水的质量,若将燃烧产物通过浓硫酸,浓硫酸的质量会增加1.08g为水的质量,水的物质的量为:$\frac{1.08g}{18g/mol}$=0.06mol,二氧化碳质量为:3.06g-1.08g=1.98g,其物质的量为:$\frac{1.98g}{44g/mol}$=0.045mol,
故有机物A中C原子数目为:N(C)=$\frac{0.045mol}{0.015mol}$=3、H原子数目为:N(H)=$\frac{0.06mol×2}{0.015mol}$=8,故A分子中O原子数目为:N(O)=$\frac{92-12×3-8}{16}$=3,有机物A的分子式为C3H8O3;
4.6gA的物质的量为:$\frac{4.6g}{92g/mol}$=0.05mol,与足量的金属钠反应,生成的气体在标准状况下的体积为1.68L,即氢气的物质的量为$\frac{1.68L}{22.4L/mol}$=0.075mol,A不与纯碱反应,则A没有-COOH,故有机物含有-OH,羟基数目=$\frac{0.075mol×2}{0.05mol}$=3,
故A的结构简式为: ,
,
答:有机物A的分子式为C3H8O3,结构简式为 .
.
点评 本题考查有机物分子式与结构确定,属于计算型推断,题目难度中等,根据原子守恒确定有机物分子式是关键,注意掌握常见有机物结构与性质.

| A. | 若C为固体,则B一定是气体 | B. | B和C一定都是气体 | ||
| C. | B和C可能都是固体 | D. | B和C不可能都是气体 |
①CO2 ②XeF6 ③PCl3 ④SO2 ⑤BF3 ⑥N2 ⑦P4 ⑧PCl5( )
| A. | ①③⑥⑦ | B. | ①④⑤ | C. | ①④⑥ | D. | ②③④⑤ |
| A. | 乙烯可作水果的催熟剂 | B. | SO2可用于杀菌消毒 | ||
| C. | 2H和3H可用于制造氢弹 | D. | 裂化汽油可用作萃取剂 |
| A. | 要检验某溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 用乙醇制取乙烯时所用温度计的位置与石油分馏时所用温度计的位置不同 | |
| C. | 用氨水清洗试管壁附着的银镜 | |
| D. | 制取乙炔时药品是电石和饱和食盐水,仪器用启普发生器 |
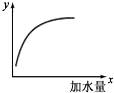 如图表示 25℃时,向0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )
如图表示 25℃时,向0.1mol•L-1的一元弱酸HA中加水稀释过程的变化图象,则图中纵坐标y表示的是( )| A. | c(H+) | B. | HA的电离平衡常数Ka | ||
| C. | $\frac{c({H}^{+})}{c(HA)}$ | D. | 水的离子积常数Kw |
| A. | CO2分子的结构式:O=C=O | |
| B. | 氯气分子的电子式 Cl:Cl | |
| C. | Cl-的离子结构示意图: | |
| D. | 原子核内有10个中子的氧原子${\;}_{8}^{16}O$ |
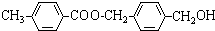 ,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志.
,从A出发,可发生图示中的一系列反应.其中M属于高分子化合物,J和K互为同分异构体,N的产量可作为衡量一个国家石油化工发展水平的标志.
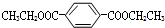 K
K
 ;
;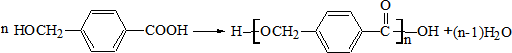 ;
;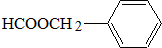 .
.