题目内容
【题目】氨既是实验室中常用试剂,也是工业上重要原料。
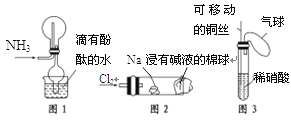
(1)某学习小组欲制备少量的氨水。供选用的试剂有:①NH4Cl②(NH4)2CO3 。提供的装置如下,请回答下列问题:
①装置A试管内发生反应的化学方程式为__________;
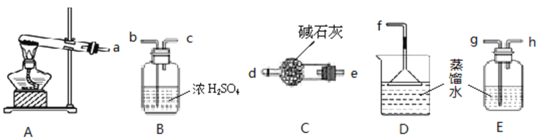
②从提供的仪器中选择并组装一套本实验的合理、简洁装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→____;
(2)氨在氧气中燃烧,生成水和一种单质。
已知:N2(g)+3H2(g)2NH3(g)△H= -92.4kJ·mol-1
2H2(g)+ O2(g)= 2H2O(l)△H= -572kJ·mol-1
写出氨在氧气中燃烧生成液态水和气态单质的热化学方程式:_________;
(3)已知在一定条件下,将1molN2和3molH2混合于一个10L的密闭容器中发生的反应为N2+3H2![]() 2NH3,5min后达到平衡,平衡时氨的体积分数为25%。
2NH3,5min后达到平衡,平衡时氨的体积分数为25%。
①该反应的平衡常数=_____;
②从反应开始到平衡时,N2的反应速率![]() (N2)=______;
(N2)=______;
(4)工业上以氨气、空气为主要原料制取硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g)2NO2(g)△H>0。该反应的反应速率(![]() )随时间(
)随时间(![]() )变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。
)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)______。

A.在![]() 时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
B.在![]() 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
C.在![]() 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
D.在![]() 时,容器内NO2的体积分数是整个过程中的最大值
时,容器内NO2的体积分数是整个过程中的最大值
(5)为检验氨气与酸反应得到的某种常见氮肥的成分,某同学进行了以下实验:①加热氮肥样品产生气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分可能是_____________(填选项序号);
A.NH4Cl B.(NH4)2CO3C.NH4HCO3D.NH4NO3
(6)硝酸厂常用Na2CO3溶液吸收处理尾气NO2生成CO2。若9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是_________________。
【答案】(NH4)2CO3![]() 2NH3↑+CO2↑+H2O e d f 4NH3(g)+ 3O2(g)= 2N2(g)+ 6H2O(l)△H=-1531.2 kJ·mol-1 K =18.3 0.008mol/(L﹒min) AB C 2NO2+CO
2NH3↑+CO2↑+H2O e d f 4NH3(g)+ 3O2(g)= 2N2(g)+ 6H2O(l)△H=-1531.2 kJ·mol-1 K =18.3 0.008mol/(L﹒min) AB C 2NO2+CO![]() = NO
= NO![]() +NO
+NO![]() +CO2
+CO2
【解析】
碳酸铵加热分解生成氨气、二氧化碳和水,通过盛有碱石灰的干燥管除去二氧化碳,再通入水中,氨气极易溶于水容易发生倒吸,用D吸收可以防止倒吸;根据已知热化学方程式,结合盖斯定律分析解题;根据平衡常数的表达式和平衡状态计算平衡常数,根据化学速率公式计算,结合影响化学平衡的因素分析解题;根据氮肥分解产物的性质确定产物并推断氮肥的成分;根据电子守恒书写发生反应的离子方程式。
(1)碳酸铵加热分解生成氨气、二氧化碳和水,发生反应的化学方程式为:(NH4)2CO3![]() 2NH3↑+CO2↑+H2O;
2NH3↑+CO2↑+H2O;
②碳酸铵分解的气体含有二氧化碳,通过盛有碱石灰的干燥管除去二氧化碳,再通入水中,氨气极易溶于水容易发生倒吸,用D吸收可以防止倒吸,则按气流方向连接顺序为a→e→d→f;
(2)①N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1,②2H2(g)+O2(g)═2H2O(l)△H=-572kJmol-1,依据盖斯定律②×3-①×②得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1531.2 kJmol-1 ;
(3)①平衡时氨的体积分数为25%,则
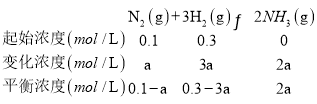
![]() =0.25,解得:a=0.04,该反应的平衡常数表达式K=
=0.25,解得:a=0.04,该反应的平衡常数表达式K= 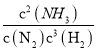 =
=![]() =18.3;
=18.3;
②N2的反应速率v(N2)=![]() =
=![]() =0.008mol/(L﹒min);
=0.008mol/(L﹒min);
(4)A.该反应正反应是气体物质的量减小的反应,恒温恒容下条件下,压强不变,说明到达平衡,故A正确;
B.正反应是放热反应,升高温度平衡向逆反应移动,在t2时,正、逆速率都增大,且正反应速率增大更多,平衡向正反应移动,该反应正反应是气体体积减小的反应,增大压强平衡向正反应进行,转化率增大,故B正确;
C.恒容条件下,反应混合气体的总质量不变,密度始终不变,所以不能说明反应达到平衡状态,故C错误;
D.由图可知,在t2时,改变条件平衡向正反应移动,t3时到达平衡,t4时瞬间正反应速率不变,逆反应速率减小,平衡向正反应进行,应是NO2降低的浓度,故容器内NO2的体积分数在t3时值的最大,故D错误;
故答案为AB;
(5)加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,该气体为氨气,说明含有铵根离子,另一种气体能使澄清石灰水变浑浊,说明碳酸根离子或碳酸氢根离子;取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化,说明没有碳酸氢根离子,说明盐中含有铵根离子和碳酸根离子,所以氮肥的主要成分NH4HCO3,故答案为C;
(6)9.2gNO2的物质的量![]() =0.2mol,即0.2molNO2和Na2CO3溶液完全反应时转移电子0.1mol,则2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2。
=0.2mol,即0.2molNO2和Na2CO3溶液完全反应时转移电子0.1mol,则2molNO2和Na2CO3溶液反应时转移电子1mol,则N的化合价分别有+4价变化为+5价和+3价,在碱性溶液中应生成NO3-和NO2-,反应的离子方程式为:2NO2+CO32-=NO3-+NO2-+CO2。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D