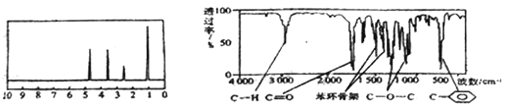
题目内容
【题目】某碱金属M及其氧化物(M2O)组成的混和物13.3g,加足量水充分反应后的溶液经蒸发结晶,得干燥固体16.8g,求该混和物的成分_________及其质量____________。
【答案】K,K2O 9.4g,3.9g
【解析】
解答本题关键是取极值法:假设13.3g全部是碱金属M,根据生成碱的质量,通过方程式列出比例式,计算M的相对原子质量,再假设13.3g全部是氧化物M2O根据生成碱的质量,通过方程式列出比例式,计算M的相对原子质量,进而判断元素名称。
根据碱金属和水反应的通式进行计算。由2M+2H2O=2MOH+H2![]() ,M2O+H2O=2MOH反应可知,设金属M的相对原子质量为a,假设13.3g全部是碱金属,则
,M2O+H2O=2MOH反应可知,设金属M的相对原子质量为a,假设13.3g全部是碱金属,则![]() =
=![]() ,解得约a=65;假设13.3g全部是氧化物(M2O),则
,解得约a=65;假设13.3g全部是氧化物(M2O),则![]() =
=![]() ,解得约a=25;根据碱金属相对原子质量为25<a<65,所以M为钾;设钾的质量为xg,氧化钾的质量为yg,则有x+y= 13.3;(
,解得约a=25;根据碱金属相对原子质量为25<a<65,所以M为钾;设钾的质量为xg,氧化钾的质量为yg,则有x+y= 13.3;(![]() +
+![]() )
)![]() (39+17)= 16.8;解得x=9.4g;y=3.9g;答案:K,K2O;9.4g,3.9g。
(39+17)= 16.8;解得x=9.4g;y=3.9g;答案:K,K2O;9.4g,3.9g。

 名校课堂系列答案
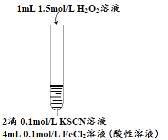
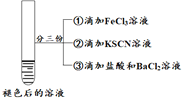
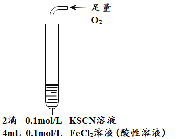
名校课堂系列答案【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关
【题目】分别进行下表所示实验,实验现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 测量熔融状态下NaHSO4的导电性 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、 |
B | 蘸有浓氨水的玻璃棒靠近X | 有白烟产生 | X可能为浓盐酸 |
C | 将甲烷与氯气按体积比1:4混合于试管中光照 | 反应后混合气体能使润湿的石蕊试纸变红 | 生成的氯代甲烷具有酸性 |
D | 将AlCl3溶液加热蒸干 | 得到白色固体 | 白色固体成分为纯净的AlCl3 |
A.AB.BC.CD.D
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
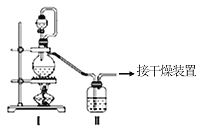
为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→_______(按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____(填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____。
③装置Ⅴ生成NOCl的化学方程式是_____。
④装置Ⅵ的作用为_____,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。