题目内容
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:

回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是_______。
(2)能够提高“碱浸”效率的方法有______(至少写两种)。
(3)“碱浸”过程中,铝溶解的离子方程式为_____。
(4)实验室模拟“碱浸”后过滤的操作,需用到的玻璃仪器有_____;过滤后需洗涤,简述洗涤的操作过程:_____。
(5)LiCoO2参与“还原”反应的离子方程式为_______。
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示:

则浸出过程的最佳条件是______。
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为______(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g2=0.3,溶液体积变化忽略不计)。
(8)写出“高温烧结固相合成”过程的化学方程式:_______。
【答案】放电有利于Li+向正极移动并进入正极材料 粉碎、适当增大NaOH的浓度、适当升高温度等 2Al+2H2O+2OH-=2AlO2-+3H2↑ 漏斗、烧杯、玻璃棒 沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次 2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑ 75℃,30 min 9.3 (4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O2![]() 4LiNi1-x-yCoxMnyO2+2CO2+4H2O
4LiNi1-x-yCoxMnyO2+2CO2+4H2O
【解析】
(1)“放电处理”有利于锂在正极的回收,Li+从负极中脱出,经由电解质向正极移动;
(2)提高浸出率的方法有粉碎、适当增大NaOH的浓度、适当升高温度等;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
(4)过滤需用到的玻璃仪器有漏斗、烧杯、玻璃棒;洗涤沉淀的操作为:沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
(5)LiCoO2中Li元素为+1价,O元素为-2价,故Co元素化合价为+3价,LiCoO2为难溶物,H2SO4为电解质,H2O2还原LiCoO2中+3价Co元素,由此写出反应的离子方程式;
(6)由图可知,在75℃,30 min条件下钴的浸出率最高;
(7)根据溶度积常数及水的离子积,逐步推理得出答案;
(8)Ni2+、Co2+、Mn2+与NH3![]() H2O反应生成Ni(OH)2、Co(OH)2、Mn(OH)2与Li2CO3,并高温烧结固相合成,根据原子守恒可得到化学方程式。
H2O反应生成Ni(OH)2、Co(OH)2、Mn(OH)2与Li2CO3,并高温烧结固相合成,根据原子守恒可得到化学方程式。
(1)放电时,负极上生成锂离子,锂离子向正极移动并进入正极材料中,所以“放电处理”有利于锂在正极的回收,
故答案为:放电有利于Li+向正极移动并进入正极材料;
(2)提高浸出率的方法有粉碎、适当增大NaOH的浓度、适当升高温度等,
故答案为:粉碎、适当增大NaOH的浓度、适当升高温度等;
(3)“碱浸”过程中,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(4)过滤需用到的玻璃仪器有漏斗、烧杯、玻璃棒;洗涤沉淀在过滤器中进行,其操作为:沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
故答案为:漏斗、烧杯、玻璃棒;沿玻璃棒向过滤器中加水至浸没沉淀,待水滤出后重复操作2~3次;
(5)LiCoO2中Li元素为+1价,O元素为-2价,故Co元素化合价为+3价,LiCoO2为难溶物,H2SO4为电解质,H2O2还原LiCoO2中+3价Co元素,反应的离子方程式为2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑,
故答案为:2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2↑;
(6)由图可知,在75℃,30 min条件下钴的浸出率最高,
故答案为:75℃,30 min;
(7)Ksp[Co(OH)2]=4.0×10-15,沉淀完全时c(OH-)=![]() =
=![]() =2×10-5mol/L,c(H+)=
=2×10-5mol/L,c(H+)=![]() =
=![]() =5×10-10mol/L,pH=-lgc(H+)=-lg5×10-10=9.3,
=5×10-10mol/L,pH=-lgc(H+)=-lg5×10-10=9.3,
故答案为:9.3;
(8)Ni2+、Co2+、Mn2+与NHspan>3![]() H2O反应生成Ni(OH)2、Co(OH)2、Mn(OH)2与Li2CO3,并高温烧结固相合成,根据原子守恒可得到化学方程式为(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O2
H2O反应生成Ni(OH)2、Co(OH)2、Mn(OH)2与Li2CO3,并高温烧结固相合成,根据原子守恒可得到化学方程式为(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O2![]() 4LiNi1-x-yCoxMnyO2+2CO2+4H2O,
4LiNi1-x-yCoxMnyO2+2CO2+4H2O,
故答案为:(4-4x-4y)Ni(OH)2+4xCo(OH)2+4yMn(OH)2+2Li2CO3+O2![]() 4LiNi1-x-yCoxMnyO2+2CO2+4H2O。
4LiNi1-x-yCoxMnyO2+2CO2+4H2O。

【题目】游离态氮称为惰性氮,游离态氮转化为化合态氮称之为氮的活化,在氮的循环系统中,氮的过量“活化”,则活化氮开始向大气和水体过量迁移,氮的循环平衡被打破,导致全球环境问题。
Ⅰ. 氮的活化
工业合成氨是氮的活化重要途径之一,在一定条件下,将N2 和 H2 通入到体积为0.5L的恒容容器中,反应过程中各物质的物质的量变化如图所示:

(1)10min内用NH3表示该反应的平均速率,v(NH3)=____________。
(2)在第10min和第25min改变的条件可能分别是_________、________(填字母)。
A.加了催化剂 B. 升高温度 C. 增加NH3的物质的量
D.压缩体积 E.分离出氨气
(3)下列说法能说明该可逆反应达到平衡状态的是__________(填字母)。
A. 容器中气体密度不变 B. 容器中压强不变
C. 3v(H2)正=2v(NH3)逆 D. N2、H2、NH3分子数之比为1∶3∶2
Ⅱ.催化转化为惰性氮 已知:SO2、CO、NH3等都可以催化还原氮氧化物生成惰性氮。
(4)在250C、101KPa时,N2(g)+3H2(g) ![]() 2NH3(g) △H1= -92.4kJ/mol.
2NH3(g) △H1= -92.4kJ/mol.
2H2(g)+O2(g)=2H2O(l) △H2= -571.6 kJ/mol
N2(g)+O2(g)=2NO(g) △H3= +180kJ/mol
则NO与NH3反应生成惰性氮的热化学方程式______________________________。
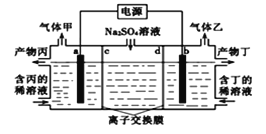
(5)在有氧条件下,新型催化剂M能催化CO与NOx反应生成N2。现向某密闭容器中充入等物质的量浓度的NO2和CO气体,维持恒温恒容,在催化剂作用下发生反应:
4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H<0,相关数据如下:
N2(g)+4CO2(g) △H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) /mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) /mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①计算此温度下的化学平衡常数K=______,
②实验室模拟电解法吸收NOx装置如图,(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验(a<b),电解时NO2发生反应的电极反应式:_________________________________。