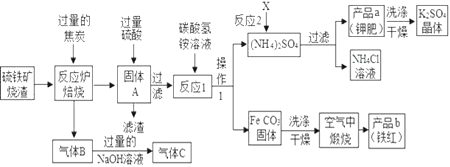
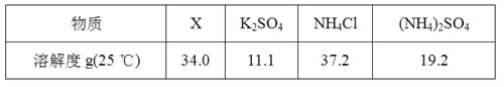
题目内容
【题目】铁红的性质实验。
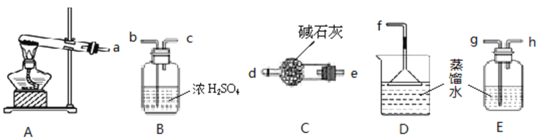
(1)实验装置
已知:草酸晶体(H2C2O4·3H2O)在浓H2SO4作用下受热分解,化学方程式为H2C2O4·3H2O![]() CO2↑+CO↑+4H2O。
CO2↑+CO↑+4H2O。

①实验前应先______。
②进入E中的气体是纯净、干燥的一氧化碳,则B、D中的试剂依次是____、___(填字母编号)。
A.浓硫酸B.澄清的石灰水C.氢氧化钠溶液
③C装置的作用是___________。
(2)数据分析与计算:用SDTQ600热分析仪对氧化铁和一氧化碳进行热反应分析,获得相关数据,绘制成管内剩余固体质量反应温度的关系如图。

已知铁的氧化物有FeO、Fe3O、Fe2O3,在一定的条件下,都能够逐步失去其中的氧,最终被还原为铁。
①800 ℃以上时,管内固体成分的化学式为___________。
②写出管内固体质量由48 g变为46.4 g时反应的化学方程式__________。
(3)实验评价:请指出问题讨论中实验装置的一个明显缺陷___________。
【答案】检查装置气密性 C A 检验二氧化碳是否被除尽 Fe 3Fe2O3+CO![]() 2Fe3O4+CO2 缺少尾气处理装置
2Fe3O4+CO2 缺少尾气处理装置
【解析】
根据实验目的及装置分析实验前的操作、除杂的过程及装置的作用;根据物质性质及固体质量的变化计算分析反应产物,书写反应方程式;根据装置可能产生的有害气体分析装置的缺陷。
(1)①实验前应先检查装置的气密性,否则会由于漏气使实验失败。故答案为:检查装置气密性;
②由图示可知混合气体中含有二氧化碳和水,B、D装置目的是除杂,二氧化碳能被碱溶液吸收,先通过B中的氢氧化钠溶液除去二氧化碳,再通过C检验二氧化碳是否除尽,再经过D中的浓硫酸除去水,故答案为:C ;A;
③C装置的目的是检验二氧化碳,故答案为:检验二氧化碳是否被除尽;一氧化碳中的二氧化碳常用氢氧化钠溶液吸收,一氧化碳常用浓硫酸干燥;
(2)由铁的氧化物均能够逐步失去其中的氧,管内固体质量不再减少,最后剩余固体为铁。根据固体质量的减少量可知开始一氧化碳与氧化铁反应生成四氧化三铁,随着温度升高再生成氧化亚铁,最后生成铁,所以在管内固体质量由48 g变为46.4 g时反应物是一氧化碳和氧化铁,生成物是四氧化三铁和二氧化碳,用观察法配平得:3Fe2O3+CO![]() 2Fe3O4+CO2,故答案为:Fe;3Fe2O3+CO
2Fe3O4+CO2,故答案为:Fe;3Fe2O3+CO![]() 2Fe3O4+CO2;
2Fe3O4+CO2;
(3)装置的尾部通过碱石灰,无法吸收未反应的CO气体,而CO有毒,所以缺少尾气处理装置,故答案为:缺少尾气处理装置。

【题目】某小组在Fe2+检验实验中观察到异常现象,为探究“红色褪去”的原因,进行如下实验:
编号 | 实验I | 实验II | 实验III |
实验步骤 |
| 将实验I褪色后的溶液分三份分别进行实验
| 为进一步探究“红色褪去”的原因,又进行以下实验 ① ②取反应后的溶液,滴加盐酸和BaCl2溶液 |
现象 | 溶液先变红,片刻后红色褪去,有气体生成(经检验为O2) | ①无明显现象 ②溶液变红 ③产生白色沉淀 | ①溶液变红,一段时间后不褪色。 ②无白色沉淀产生 |
分析上述三个实验,下列叙述不正确的是
A.在此实验条件下H2O2氧化Fe2+的速率比氧化SCN-的速率快
B.通过实验Ⅱ推出实验Ⅰ中红色褪去的原因是由于SCN-被氧化
C.通过实验Ⅰ和实验Ⅲ对比推出红色褪去只与H2O2的氧化性有关
D.综上所述,实验Ⅰ中红色褪去的原因与化学平衡移动原理无关