题目内容
【题目】T℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO42-)=-lgc(SO42-)。下列说法正确的是( )
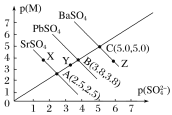
A.溶度积:BaSO4>PbSO4>SrSO4
B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4
C.Z点对应的溶液中c(Ba2+)>c(SO42-),c(Ba2+)·c(SO42-)等于1×10-25
D.BaSO4不可能转化成PbSO4
【答案】B
【解析】
p(M)越大,则c(M)越小。
A. p(M)越大,则c(M)越小,即Pb2+、Ba2+、Sr2+的物质的量浓度越小;同理p(SO42-)越大,c(SO42-)越小。由图可知,p(SO42-)相同时,BaSO4、PbSO4、SrSO4对应的p(M)依次减小,所以三者的溶度积依次增大,即BaSO4<PbSO4<SrSO4,A项错误;
B. 由图可知,Y点对应的SrSO4溶液中c(SO42-)·c(Sr2+)<Ksp(SrSO4),故Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4,B项正确;
C. 由图可知,Z点对应的溶液中c(Ba2+)>c(SO42-),c(Ba2+)·c(SO42-)=1×10-10,C项错误;
D. 沉淀的转化是可逆的,若向BaSO4悬浊液中加入浓度较大的含Pb2+的溶液, BaSO4能转化成PbSO4,D项错误。
综上所述,说法正确的是B,故选B。

 考前必练系列答案
考前必练系列答案【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
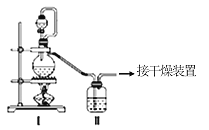
为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
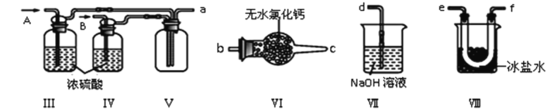
①装置连接顺序为a→_______(按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____(填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____。
③装置Ⅴ生成NOCl的化学方程式是_____。
④装置Ⅵ的作用为_____,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
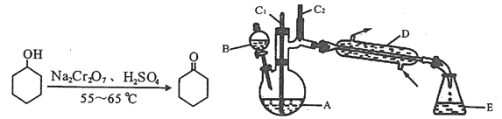
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如图:
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液___;
②蒸馏不能分离环己酮和水的原因是___。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___;
②b中水层用乙醚萃取的目的是___;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作d中,加入NaCl固体的作用是__。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为__。