题目内容
4.下列Ⅰ、Ⅱ叙述正确并且有因果关系的是( )| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.二氧化硅没有导电性;
C.Fe3+有氧化性,能被Cu还原;
D.氯气有毒,但NaOH溶液具有强腐蚀性.
解答 解:A.二氧化硫具有还原性,能被强氧化剂溴氧化,溴被还原而褪色,该反应体现二氧化硫的还原性而不是漂白性,故A错误;
B.二氧化硅没有导电性,二氧化硅应用于光导纤维是利用光的全反射原理,故B错误;
C.Fe3+有氧化性,能被Cu还原而腐蚀铜,所以用30%的FeCl3溶液腐蚀铜箔制造印刷线路板,故C正确;
D.氢氧化钠具有腐蚀性,对人会造成伤害,所以大量氯气泄漏时用肥皂水浸湿的软布蒙面并迅速离开现场,故D错误;
故选C.
点评 本题考查元素化合物知识,侧重考查元素化合物性质,明确物质性质及其反应原理是解本题关键,注意二氧化硫漂白性和还原性区别,易错选项是B.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
14.在标准状况下,相同体积的下列物质中所具有的质量最大的是( )
| A. | H2O | B. | H2 | C. | CH4 | D. | Cl2 |
15.电解NO制备NH4NO3,其工作原理如图所示.下列说法不正确的是( )


| A. | 甲电极为阴极 | |
| B. | 为使电解产物全部转化为NH4NO3,需补充的物质为NH3 | |
| C. | 乙电极的电极反应式是:NO-3e-+4OH-=NO3-+2H2O | |
| D. | 该反应中NO既是氧化剂又是还原剂 |
12.在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
| A. | 2H2(g)+O2(g)=2H2O(g)△H1; 2H2(g)+O2(g)=2H2O(l)△H2 | |
| B. | S(g)+O2(g)=SO2(g)△H1; S(s)+O2(g)=SO2(g)△H2 | |
| C. | $\frac{1}{2}$C(s)+O2(g)=CO(g)△H1; C(s)+O2(g)=CO2(g)△H2 | |
| D. | HCl(g)=$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)△H1; H2(g)+Cl2(g)=2HCl(g)△H2 |
9.从平时的学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望在今后的实验中,要克服不规范的操作.请找出下列图示中正确的实验操作( )
| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. | 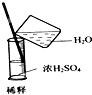 稀释浓硫酸 | D. |  向试管中滴加液体 |
15.对下列各图曲线表征的信息解毒错误的是( )
| A. | 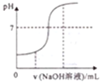 向酸性溶液中滴加NaOH溶液时pH随NaOH溶液体积变化关系 | |
| B. |  某反应为放热反应,催化剂能改变反应的焓变 | |
| C. |  不同温度下,水溶液中c(H+)与c(OH-)变化关系 | |
| D. | 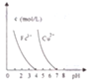 pH=7时,Cu2+、Fe3+都能沉淀完全 |
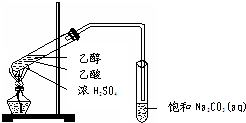 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.
CH3COOC2H5+H2O,乙酸乙酯的密度比水小(填“大”或“小”),有芳香味.