题目内容
9.从平时的学生实验中我们发现,同学们在进行实验时,出现许多不正确的操作方式,希望在今后的实验中,要克服不规范的操作.请找出下列图示中正确的实验操作( )| A. |  除去CO的CO2 | B. |  萃取时振荡混合液 | ||
| C. | 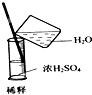 稀释浓硫酸 | D. |  向试管中滴加液体 |
分析 A.洗气装置中导气管遵循“长进短出”原则;
B.左手握住活塞部分,右手食指顶住塞子,把分液漏斗倒转过来振荡,使两种液体充分混合;
C.量筒只能量取溶液,不能作反应容器、不能配制溶液,稀释浓硫酸时将浓硫酸倒入水中;
D.向试管中滴加溶液时,胶头滴管应该悬空.
解答 解:A.洗气装置中导气管遵循“长进短出”原则,否则易导致氢氧化钠溶液被排出而达不到实验目的,故A错误;
B.左手握住活塞部分,右手食指顶住塞子,把分液漏斗倒转过来振荡,使两种液体充分混合,使溶质尽可能的被萃取,故B正确;
C.量筒只能量取溶液,不能作反应容器、不能配制溶液,如果稀释浓硫酸,应该将量筒紧贴烧杯口,把浓硫酸倒入烧杯中并不断搅拌,防止放出的热量使局部温度过高而溅出液体,故C错误;
D.向试管中滴加溶液时,胶头滴管应该悬空,否则会污染胶头滴管,故D错误;
故选B.
点评 本题考查实验方案评价,涉及实验基本操作,同时该题侧重于学生的分析能力、实验能力和评价能力的考查,注意把握操作方法,易错选项是D,很多同学往往害怕溶液会滴到试管外面而将胶头滴管伸入试管中,只有氢氧化亚铁的制备中将胶头滴管伸入试管中的液面下,为易错点.

练习册系列答案
相关题目
20.下列说法正确的是( )
| A. | 环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 | |
| B. | 食盐中加入少量碘化钾,食用后可补充人体内碘元素的不足 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 晶体硅是通信工程中制作光导纤维的主要原料 |
17.对实验过程中出现的异常现象进行探究,是实施素质教育、培养创新精神的有效途经.
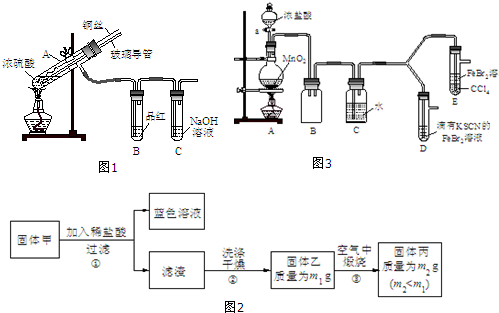
【实验1】用图1实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在
铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S.查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2.为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2实验:
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是在熄灭酒精灯后,B中的液体不会倒吸.
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(3)确定乙是否煅烧完全的操作是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g).
(4)煅烧过程中一定发生的化学反应方程式为2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+2SO2.
【实验2】某化学兴趣小组设计了如图3实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱.
(5)根据下列实验操作和现象,填写实验结论.
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了异常的变化:D装置中,红色慢慢褪去;E装置中,CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因过量氯气和SCN-反应:2SCN-+Cl2=2Cl-+(SCN)2,使SCN-浓度减小,则Fe3++3SCN-?Fe(SCN)3平衡逆向移动而褪色;
请设计简单实验证明上述解释取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理,或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-.

【实验1】用图1实验装置进行铜与浓硫酸的反应,实验中发现试管内除了产生白色硫酸铜固体外,在
铜丝表面还有黑色固体甲生成,甲中可能含有黑色的CuO、CuS、Cu2S.查阅资料:CuS和Cu2S均为黑色固体,常温下都不溶于稀盐酸,在空气中煅烧,均转化为CuO和SO2.为了探究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2实验:
(1)上述实验装置除了有尾气吸收装置外,还有一个显著的优点是在熄灭酒精灯后,B中的液体不会倒吸.
(2)固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有泥三角、坩埚(坩埚钳).
(3)确定乙是否煅烧完全的操作是重复操作(再煅烧、冷却、称量),直至恒重(前后两次称量差不超过0.001g).
(4)煅烧过程中一定发生的化学反应方程式为2CuS+3O2$\frac{\underline{\;煅烧\;}}{\;}$2CuO+2SO2.
【实验2】某化学兴趣小组设计了如图3实验装置(尾气吸收装置未画出),探究Cl2、Br2、Fe3+的氧化性强弱.
(5)根据下列实验操作和现象,填写实验结论.
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅱ.Cl2和Br2反应生成的BrCl呈红色,沸点约5℃,与水发生水解反应. ⅲ.AgClO、AgBrO均可溶于水. |
请设计简单实验证明上述解释取少量褪色后的溶液,滴加KSCN溶液,若溶液变红色,则上述推测合理,或取少量褪色后的溶液,滴加FeCl3溶液,若溶液不变红,则上述推测合理.
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因BrCl+H2O=HBrO+HCl反应只产生Cl-,不产生Br-.
4.下列Ⅰ、Ⅱ叙述正确并且有因果关系的是( )
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
14.下列关于${\;}_{6}^{12}$C、${\;}_{6}^{13}$C、${\;}_{6}^{14}$C的说法正确的是( )
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
20.下列有关实验的现象与对应结论均正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将一小块钠放入乙醇中 | 产生大量气泡 | 该乙醇中含有大量的水 |
| B | 铜片加入浓硝酸中 | 产生红棕色气体 | 浓硝酸具有氧化性 |
| C | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 过氧化钠作呼吸面具中的供氧剂 | 淡黄色粉末变白 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| A. | A | B. | B | C. | C | D. | D |