题目内容
【题目】今年是门捷列夫发现元素周期律 150 周年。下表是元素周期表的一部分,W、X、Y、Z 为短周期主族元素,W 原子最外层电子数是其内层电子数的 3 倍。下列说法正确的是( )
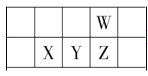
A.原子半径:W>X
B.最高价氧化物的水化物酸性:Y>Z
C.气态氢化物沸点:Z>W
D.气态氢化物热稳定性:Z<W
【答案】D
【解析】
W原子最外层电子数是其内层电子数的3倍,根据核外电子排布规律,即W为O,根据四种元素在周期表位置,推出四种元素,然后据此分析;
W原子最外层电子数是其内层电子数的3倍,根据核外电子排布规律,即W为O,根据四种元素在周期表位置,X为Si,Y为P,Z为S,
A、同主族从上到下原子半径增大,即r(O)<r(S),故A错误;
B、两种元素最高价氧化物对应的水化物分别是H3PO4、H2SO4,酸性强弱:H2SO4>H3PO4,故B错误;
C、两种元素的氢化物是H2O和H2S,H2O分子间存在氢键,其沸点比没有分子间氢键的H2S高,故C错误;
D、O的非金属性强于S,即H2O比H2S稳定,故D正确;
答案为D。

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼