题目内容
【题目】二氧化硫和氮氧化物都是常见的大气污染物,回答下列相关问题。
某温度下氮氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
i.2NO(g)+Cl2(g)2ClNO(g) △H 1<0 其平衡常数为K1
ii.2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) △H2<0 其平衡常数为K2
(1)现有反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),则此反应的平衡常数K3=_______(用K1、K2表示),反应热△H3=__________(用△H1、△H2表示)。
(2)为研究不同条件对反应ii的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO2和足够的NaCl(s),10min时反应ii达到平衡。测得平衡时NO2的转化率α1(NO2) =50%,则:
①10min内υ(ClNO)=_________ ,平衡常数K2=___________;
②若其它条件不变,使反应在恒压条件下进行,平衡时NO2转化率为α2(NO2),则:α1(NO2)______α2(NO2)(填“>”“<”或“=”)。
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,下列有关吸收液中粒子关系正确的是______________。
a.c(Na+)=c(HSO3-)+2c(SO32-)
b.c(Na+) > c(HSO3-) =c(SO32-) > c(H+) = c(OH—)
c.c(Na+) > c(HSO3—) + c(SO32—) +c(H2SO3)
d.c(OH-) +c(SO32-)=c(H2SO3)+c(H+)
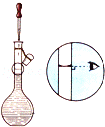
(4)工业上也可以用Na2SO3溶液吸收SO2,并用电解法处理吸收后所得溶液以实现吸收液的回收再利用,装置如图所示,则
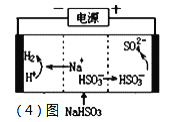
①工作一段时间后,阴极区溶液的pH______(填“增大”“减小”或“不变”);
②写出阳极的电极反应式_______________________。
【答案】K22/K1 2△H2-△H1 0.0025mol/(L·min) 10 < ac 增大 HSO3-—2e-+H2O=SO42-+3H+
【解析】
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),根据ii ×2- i 得到反应热△H 3,根据平衡常数计算公式结合反应ii、i求出此反应的平衡常数K3与K1、K2的关系式;
(2)①根据平衡时NO2的转化率可以求出其它物质的变化量,反应达到平衡后各物质的浓度,根据平衡常数的计算公式进行计算平衡常数;
②反应在恒容条件下进行,达到平衡时压强减少,若先在恒压条件下进行,可在平衡时增大压强,此时平衡向正反应方向进行,进而分析NO2转化率变化规律;
(3)若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,说明溶液的成份为Na2SO3和NaHSO3,根据电荷守恒和物料守恒进行分析;
(4)①阴极区溶液中的H+被还原成H2,氢离子浓度减小,氢氧根离子浓度增大,溶液的pH增大;
②阳极区HSO3-被氧化生成SO42-,据此写出电极反应方程式。
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g),根据盖斯定律ii ×2- i 得到,反应热△H 3=2△H 2-△H1 ;K1= c2(ClNO)/c(Cl2)×c(NO),K2= c(ClNO)/c2(NO2),K3= c(Cl2)×c2(NO)/ c4(NO2),所以4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)反应的的平衡常数K3=(K2)2/K1;
故答案为:K22/K1;2△H2-△H1;
(2)①平衡时NO2的转化率为50%,NO2的变化量为0.1mol,ClNO的变化量为 0.05mol,V(ClNO)=[0.05/2]/10=0.0025mol/(L·min) ;结合NO2的变化量可知平衡时,c(NO2)=0.05mol/L,c(ClNO)=0.025 mol/L,故平衡常数K2=![]() =10;
=10;
故答案为:0.0025mol/(L·min);10;
②反应在恒容条件下进行,达到平衡时压强减少,若先在恒压条件下进行,可在平衡时增大压强,此时平衡向正反应方向进行,所以NO2转化率增大,即:α1(NO2)<α2(NO2);
故答案为:<;
(3)a.若用一定量的NaOH溶液吸收SO2气体后所得吸收液恰好呈中性,说明溶液的成份为Na2SO3和NaHSO3,此时溶液中存在电荷守恒:c(H+)+ c(Na+)= c(HSO3-)+2 c(SO32-)+ c(OH-),溶液为中性,c(H+)= c(OH-),则a正确;
b.溶液中存在SO32-的水解与HSO3-的电离和水解,溶液中存在SO32-的水解与HSO3-的电离和水解,因此c(HSO3-) ≠c(SO32-),故b错误;
c.溶液中的水解和电离过程均相对较弱,所以溶液中的c(SO32-)> c(H2SO3),根据c(Na+)= c(HSO3-)+2 c(SO32-),所以c(Na+)> c(H2SO3)+ c(HSO3-)+ c(SO32-),故c正确;
d.由于反应后溶液呈中性,c(H+)= c(OH-);溶液中的水解和电离过程均相对较弱,所以溶液中的c(SO32-)> c(H2SO3),所以c(OH-) +c(SO32-)>c(H2SO3)+c(H+),故d错误;
故答案为:ac;
(4)①阴极区溶液中的H+被还原成H2,工作一段时间后,阴极区溶液的pH增大;
故答案为:增大;
②阳极区HSO3-被氧化生成SO42-,电极反应式HSO3-—2e-+H2O=SO42-+3H+;
故答案为:HSO3--2e-+H2O=SO42-+3H+。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
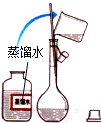
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |