题目内容
【题目】氮化钙(Ca3N2)氮化钙是一种棕色粉末,在空气中氧化,遇水会发生水解,生成氢氧化钙并放出氨。某化学兴趣小组设计制备氮化钙的实验如下:

Ⅰ.氮化钙的制备
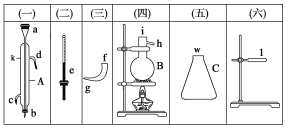
(1)连接装置后,检查整套装置气密性的方法是_______________________________________。
(2)装置A中每生成标准状况下4.48LN2,转移的电子数为___________________。
(3)装置B的作用是吸收氧气,则B中发生反应的离子方程式为______________________。装置E的作用是______________________。
(4)实验步骤如下:检查装置气密性后,装入药品;_____________________(请按正确的顺序填入下列步骤的代号)。
①点燃D处的酒精喷灯; ②打开分液漏斗活塞; ③点燃A处的酒精灯; ④停上点燃A处的酒精灯;⑤停止点燃D处的酒精喷灯
(5)请用化学方法确定氮化钙中含有未反应的钙,写出实验操作及现象_________________。
【答案】关闭分液漏斗活塞,向E中加水,没过长导管,微热烧瓶E中有气泡停止加热导管末端形成一段水柱 0.6NA 4Fe2++O2+4H+=4Fe3++2H2O 吸收空气中水蒸气、防止进入D中 ②③①⑤④ 取少量产物于试管,加入水,用排水法收集到无色气体则含钙
【解析】
制备Ca3N2应用N2与Ca反应,首先制备N2,Ca3N2在空气中氧化,遇水会发生水解,因此需要除去N2中的水蒸气,以及防止空气中氧气和水蒸气的进入,据此分析;
(1)检验装置的气密性,操作方法是:关闭分液漏斗的活塞,向E装置中加水,没过长导管,用酒精灯微热圆底烧瓶,E中长导管有气泡冒出,撤去酒精灯,E中长导管有一段水柱存在,说明气密性良好;
答案为:关闭分液漏斗的活塞,向E装置中加水,没过长导管,用酒精灯微热圆底烧瓶,E中长导管有气泡冒出,撤去酒精灯,E中长导管有一段水柱存在,说明气密性良好;
(2)生成N2的离子方程式为NO2-+NH4+![]() N2↑+2H2O,根据反应方程式,转移3mol电子,生成标准状况下的气体22.4L,则生成4.48L气体,转移电子的物质的量为
N2↑+2H2O,根据反应方程式,转移3mol电子,生成标准状况下的气体22.4L,则生成4.48L气体,转移电子的物质的量为![]() =0.6mol,即转移电子数0.6NA;
=0.6mol,即转移电子数0.6NA;
答案为0.6NA;
(3)装置B的作用是吸收氧气,利用O2的氧化性将Fe2+氧化,即离子反应方程式为4Fe2++O2+4H+=4Fe3++2H2O;Ca3N2遇水发生水解,因此装置E的作用是吸收空气中的水蒸气,防止进入D中;
答案为4Fe2++O2+4H+=4Fe3++2H2O;吸收空气中的水蒸气,防止进入D中;
(4)检查装置气密性后,因为Ca是活泼金属,容易与O2反应,因此首先利用N2排除装置中空气,即先打开分液漏斗的活塞,然后点燃A处的酒精灯,当排除装置的空气后,再点燃D处酒精喷灯,当反应完毕后,熄灭D处酒精灯,让Ca3N2在N2中冷却下来,最后熄灭A处的酒精灯,即顺序是②③①⑤④;
答案为②③①⑤④;
(5)Ca3N2与水反应Ca3N2+6H2O=3Ca(OH)2+2NH3↑,如果含有Ca,Ca也能水反应:Ca+2H2O=Ca(OH)2+H2↑,NH3极易溶于水,H2不溶于水,因此操作是取少量产物于试管中,加入水,用排水法收集到无色气体,则含有钙;
答案为取少量产物于试管中,加入水,用排水法收集到无色气体,则含有钙。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,并探究了过氧化氢的性质。请填写下列空白:
Ⅰ.测定过氧化氢的含量
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250 mL_______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为________。
(3)判断滴定到达终点的现象是_________________________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为____________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________(填“偏高”或“偏低”或“不变”)。
Ⅱ.探究过氧化氢的性质
该化学兴趣小组根据所提供的实验条件设计了两个实验,分别证明了过氧化氢的氧化性和不稳定性。(实验条件:试剂只有过氧化氢溶液、氯水、碘化钾淀粉溶液、饱和硫化氢溶液,实验仪器及用品可自选。)
请将他们的实验方法和实验现象填入下表:
实验内容 | 实验方法 | 实验现象 |
验证氧化性 | ____________ | ____________ |
验证不稳定性 | ____________ | ____________ |