��Ŀ����
����Ŀ����Ҫ�����
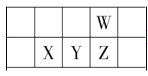
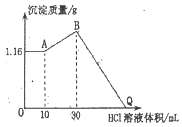
��1�����������ʣ���ͭ����ʯ��ˮ����CO2����Fe��OH��3��Һ����CaO���������������ڽ������_____������ţ���ͬ�������ڼ������������_____
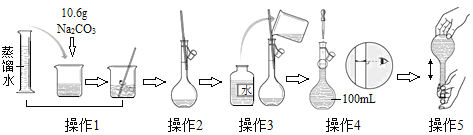
��2���ڱ�״���£�35.5g�����������_____L���������������ϣ������������ʵ�����_____mol�������ɵ���������ˮ�����500mL��Һ�������Һ�����ʵ����ʵ���Ũ����_____mol/L
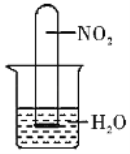
��3����ͼ��ʾ��������NO2������Թܵ�����ˮ���У��۲쵽�Թ���������ɫ��_____ɫ��Ϊ��ɫ�������Թ���Һ���������Թ��ݻ���_____�����������
���𰸡��ܢ� �� 11.2 0.5 2 ���� ![]()
��������
��1����ͭ�ǵ��ʣ���ʯ��ˮ����Һ����CO2�Ǵ����Ϊ�����������Fe��OH��3��Һ��ɢ�����Ƚ���1��100nm֮���ǽ��壻��CaO�ܹ����ᷴӦ�����κ�ˮΪ�����������������ɢ�����Ƚ���1��100nm֮���ǽ��壻
��2�����ݹ�ʽn=![]() ��c=
��c=![]() ���㣻
���㣻
��3�����ݷ���ʽ3NO2+H2O��2HNO3+NO��֪��3�������������ˮ��Ӧ����1���һ��������һ������������ˮ���ɴ˽��
��1����ͭ�ǵ��ʣ���ʯ��ˮ����Һ����CO2�Ǵ����Ϊ�����������Fe��OH��3��Һ��ɢ�����Ƚ���1��100nm֮���ǽ��壻��CaO�ܹ����ᷴӦ�����κ�ˮΪ�����������������ɢ�����Ƚ���1��100nm֮���ǽ��壻�������ڽ�����Ǣܢޣ����ڼ������������ �ݣ�
��2���ڱ�״���£�35.5g�����������![]() ��22.4L/mol��0.5mol�����ݷ���ʽ��H2+Cl2
��22.4L/mol��0.5mol�����ݷ���ʽ��H2+Cl2 ![]() 2HCl��0.5mol������0.5mol������Ӧ����1mol�Ȼ��⣬�Ȼ�������ˮ
2HCl��0.5mol������0.5mol������Ӧ����1mol�Ȼ��⣬�Ȼ�������ˮ![]() ��2mol/L��
��2mol/L��
��3��NO2����Ϊ����ɫ������������������ˮ��Ӧ�������ᣨHNO3����һ��������3NO2+H2O��2HNO3+NO��NOΪ��ɫ������������ɫ�ɺ���ɫ��Ϊ��ɫ�����ݷ���ʽ3�������������ˮ��Ӧ����1���һ��������һ������������ˮ�����Է�Ӧ����Һ���ռ�Թ������![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�