题目内容
【题目】下列化学用语表示正确的是
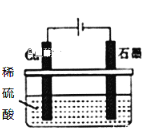
A. 碳酸的电离方程式:H2CO32H++CO32-
B. 碱性氢氧燃料电池负极的电极反应式:H2—2e-=2H+
C. 向FeBr2溶液中通入少量Cl2:2Br-+ Cl2= Br2+2Cl-
D. 如图所示,反应开始时的离子方程式:Cu+2H+![]() Cu2++H2↑
Cu2++H2↑
【答案】D
【解析】
A.碳酸为二元弱酸,属于弱电解质,分步电离;
B.氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水;
C.还原性:Fe2+大于Br-,氯气先氧化Fe2+;
D.铜作阳极,电解质为酸,阳极铜失去电子,阴极上氢离子放电。
A.碳酸为二元弱酸,分步电离,电离方程式为:H2CO3H++HCO3-,HCO3-H++CO32-,故A错误;
B.氢氧燃料碱性电池中,负极上氢气失电子和氢氧根离子反应生成水,负极极反应式为H2-2e-+2OH-═2H2O,故B错误;
C.还原性:Fe2+大于Br-,因此向FeBr2溶液中通入少量Cl2,亚铁离子先被氧化,即2Fe2++Cl2=2Fe3++2Cl-,故C错误;
D.该电解池中,阳极上铜失电子发生氧化反应:Cu-2e-═Cu2+;阴极上氢离子得电子发生还原反应,2H++2e-═H2↑;总反应的离子方程式是Cu+2H+![]() Cu2++H2↑;故D正确;
Cu2++H2↑;故D正确;
故答案选D。

 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】下列实验能达到预期目的是
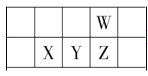
编号 | 实验内容 | 实验目的 |
A | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
C | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体,HX放出的氢气多且反应速率快 | 证明HX酸性比HY强 |
D | 向10mL 0.2mol/L NaOH溶液中滴2滴0.1mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1mol/L FeCl3溶液,又生成红褐色沉淀 | 证明在相同温度下Ksp: Mg(OH)2>Fe(OH)3 |
A. AB. BC. CD. D