题目内容
15.现代科技的高度快速发展离不开C和Si元素.(1)写出Si的基态原子核外电子排布式1s22s22p63s23p2.
(2)从电性角度分析,C、Si、O元素的非金属活泼性由强至弱的顺序为O>C>Si.
(3)CSi为同一主族的元素,CO2、SiO2的化学式相似,但结构和性质有很大的不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成上述π键,而Si、O原子间不能形成上述π键:Si原子比C原子半径大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
分析 (1)Si的原子核外有14个电子分三层排布;
(2)同周期从左到右非金属性增强,同主族从上到下非金属性减弱;
(3)Si原子比C原子半径大,Si、O原子间距离较大.
解答 解:(1)Si的原子核外有14个电子分三层排布,则其电子排布式为1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)同周期从左到右非金属性增强,则非金属性:O>C,同主族从上到下非金属性减弱,则非金属性:C>Si,所以非金属性:O>C>Si,
故答案为:O>C>Si;
(3)CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键,是因Si原子比C原子半径大,Si、O原子间距离较大,P-P轨道肩并肩重叠程度较小,不能形成上述稳定的π键,
故答案为:Si原子比C原子半径大,Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键.
点评 本题考查了核外电子排布、非金属性比较等,综合性较强,难度中等,注意把握非金属性的比较方法.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
5.在有机物分子中,不能引入羟基的反应是( )
| A. | 还原反应 | B. | 水解反应 | C. | 消去反应 | D. | 加成反应 |
6.下列化学用语使用正确的是( )
| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
3.下列叙述不正确的是( )
| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
10.下列有机反应方程式与反应类型均正确的是( )
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl 加成反应 | |
| B. |  氧化反应 氧化反应 | |
| C. | 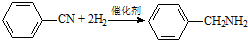 加成反应 加成反应 | |
| D. | 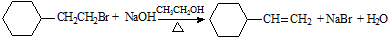 取代反应 取代反应 |
7.下列有关热化学方程式的书写及对应的表述均正确的是( )
| A. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g硫化亚铁时,放出19.12 kJ热量.则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式为2H2O(l)═2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ•mol-1,则C的燃烧热△H=-110.5 kJ•mol-1 |
4.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-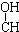 - -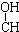 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-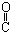 -CH2-CHO -CH2-CHO |
5.下列试剂中,能鉴别乙醇、乙酸和葡萄糖三种溶液的是( )
| A. | 水 | B. | 新制氢氧化铜浊液 | ||
| C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
