题目内容
14.下列性质的递变中,正确的是( )| A. | O、Na、S的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次增强 | ||
| C. | HF、NH3、SiH4的稳定性依次增强 | D. | HCl、HBr、HI的还原性依次减弱 |
分析 A、根据同周期元素的原子半径的递变规律判断和同主族元素原子半径的递变规律;
B、元素的金属性越强,对应的最高价氧化物的水化物的碱性越强;
C、中心元素非金属性越强,氢化物越稳定;
D、元素的非金属性越弱,对应氢化物的还原性越强.
解答 解:A.O核外有2个电子层,电子层数最小,则半径最小,S、Na原子核外有3个电子层,电子层数相同时,原子序数越大,半径越小,则有原子半径:O、S、Na依次增大,故A错误;
B.金属性:Cs>K>Li,元素的金属性越强,对应最高价氧化物的水化合物的碱性越强,则有LiOH、KOH、CsOH的碱性依次增强,故B正确;
C.非金属性:F>N>Si,元素的非金属性越强,对应的氢化物越稳定,则有:热稳定性:HF、NH3、SiH4依次减弱,故C错误;
D.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的还原性增强,则HCl、HBr、HI的还原性依次增强,故D错误.
故选B.
点评 本题考查元素周期律的递变,题目难度不大,本题注意把握元素周期律与元素周期表的关系,注意相关规律、方法的掌握.

练习册系列答案
相关题目
9.化学与社会、生产、生活紧切相关.下列说法正确的是( )
| A. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| B. | 石油干馏可得到石油气、汽油、煤油、柴油等 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | “地沟油”可用于制肥皂以及生物柴油以达到其再利用 |
5.在有机物分子中,不能引入羟基的反应是( )
| A. | 还原反应 | B. | 水解反应 | C. | 消去反应 | D. | 加成反应 |
2.NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1.0L1.0mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA | |
| D. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
9.在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ/mol |
19.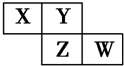 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )
15、X、Y、Z、W均为短周期元素,它们在周期表中的位置如图所示.若Y原子最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | 原子半径:W>Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>W>X | |
| C. | Z、W的气态氢化物还原性:W>Z | |
| D. | 四种元素的单质中,Z单质的熔沸点最高 |
6.下列化学用语使用正确的是( )
| A. | 氢的同位素中重氢原子的符号:13H | |
| B. | Mg2+的结构示意图: | |
| C. | 氨气的电子式: | |
| D. | Ca(ClO)2的电离方程式:Ca(ClO)2=Ca2++2ClO- |
3.下列叙述不正确的是( )
| A. | 研究有机物的组成、结构、性质、制备方法与应用的科学叫有机化学 | |
| B. | 有机物的反应与无机反应相比具有反应缓慢、产物复杂、常在水溶液中进行等特点 | |
| C. | 人们常利用有机物的性质,合成具有特定性质而自然界并不存在的有机物,满足人类的需要 | |
| D. | 高分子化合物与低分子有机物不仅在相对分子质量和结构上有差异,而且在物理性质、化学性质上也有较大差别 |
4.下列各化合物中,能发生酯化、还原、加成、消去四种反应的是( )
| A. | CH3-CH=CH-CHO | B. | CH3-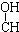 - -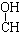 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-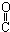 -CH2-CHO -CH2-CHO |