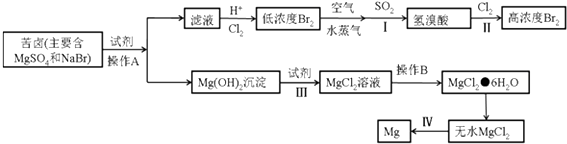
题目内容
【题目】燃料电池是一种能量转换效率高、对环境友好的化学电源,图为一种氢氧燃料电池的结构装置. 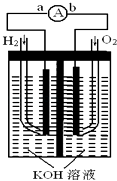
(1)电极b为该燃料电池的极(填“正”或“负”),电极方程式为;
(2)电池工作时,溶液中的OH﹣移向极(填“a”或“b”);
(3)电池工作时,在导线中电子流动方向为(用a、b表示);
(4)电池使用一段时间后,溶液的pH值(填“增大”或“减小”);
(5)当电池工作一段时间后消耗标准状况下H2为6.72L时,转移电子mol.
【答案】
(1)正;O2+2H2O+4e﹣=4OH﹣
(2)a
(3)a流向b
(4)减少
(5)0.6
【解析】解:(1.)电极b通入氧气,为该燃料电池的正极,电极方程式为O2+2H2O+4e﹣=4OH﹣ , 故答案为:正;O2+2H2O+4e﹣=4OH﹣;
(2.)原电池中阴离子向负极移动,溶液中的OH﹣移向a,故答案为:a;
(3.)电子流动由负极流向正极,所以由a流向b,故答案为:a流向b;
(4.)总的反应式为:O2+2H2=2H2O,生成水溶液浓度变稀,所以溶液的PH减小,故答案为:减少;
(5.)产生标准状况下H2 为6.72L,所以物质的量为 ![]() =0.3mol,生成1mol的氢气转移2mol的电子,所以转移电子的物质的量为:0.3mol×2=0.6mol,故答案为:0.6.
=0.3mol,生成1mol的氢气转移2mol的电子,所以转移电子的物质的量为:0.3mol×2=0.6mol,故答案为:0.6.
(1)电极b通入氧气,为该燃料电池的正极,电极方程式为O2+2H2O+4e﹣=4OH﹣;(2)原电池中阴离子向负极移动;(3)电子流动由负极流向正极;(4)总的反应式为:O2+2H2=2H2O,生成水溶液浓度变稀;(5)产生标准状况下H2 为6.72L,所以物质的量为 ![]() =0.3mol,生成1mol的氢气转移2mol的电子.
=0.3mol,生成1mol的氢气转移2mol的电子.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目