题目内容
【题目】下列反应中乙醇分子断裂的仅是碳氧键的是( )
A.乙醇与金属钠反应产生氢气
B.乙醇在浓硫酸140℃条件下反应
C.乙醇与氢卤酸发生取代反应生成卤代烃
D.乙醇在酸性重铬酸钾的氧化下生成乙醛或乙酸
【答案】C
【解析】
A、乙醇与金属钠反应产生氢气,断裂羟基中O-H键,故A错误;
B、乙醇在浓硫酸140°C条件下发生分子间脱水反应生成乙醚,一个乙醇分子断裂C-O键,另一个乙醇分子断裂O-H键,所以该反应断裂的不仅仅是C-O键,故B错误;
C、乙醇与氢卤酸发生取代反应生成卤代烃,羟基被卤素原子取代,断裂C-O键,故C正确;
D、乙醇被氧化生成乙醛或乙酸,断裂O-H键,与羟基直接相连的碳原子上的C-H键也断裂,故D错误;
故选C。

【题目】某实验小组设计实验,利用酸性KMnO4溶液与H2C2O4溶液反应,测定溶液紫色消失所需时间的方法,研究浓度对反应速率的影响。供选择的实验药品有:0.01mol·L-1酸性KMnO4溶液、0.1mol·L-1酸性KMnO4溶液、0.1mol·L-1H2C2O4溶液、0.2mol·L-1H2C2O4溶液。
(1)H2C2O4溶液与酸性KMnO4溶液反应的化学方程式为____________________________。
(2)请完成以下实验设计表。
实验 | 酸性KMnO4溶液 | H2C2O4溶液 | 褪色 时间/s | ||
c/(mol·L-1) | V/mL | c/(mol·L-1) | V/mL | ||
甲 | 0.01 | 4 | 0.1 | 2 | t1 |
乙 | a | 4 | b | 2 | t2 |
①表中a=________、b=________;
②甲组实验KMnO4的平均反应速率是:____________(用含t1的式子表示)。
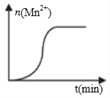
(3)测得某次实验(恒温)时,溶液中Mn2+物质的量与时间关系如图。请解释n(Mn2+)在反应起始时变化不大、一段时间后快速增大的原因:______。