题目内容
【题目】从海水中可以获得淡水、食盐并可提取镁和溴等物质.
(1)海水淡化的方法主要有(填一种);
(2)下列物质不需要经过化学变化就能从海水中获得的物质是 (填序号);
A.液溴
B.食盐
C.氢气
D.淡水
(3)从海水中提取溴和镁的流程如下: 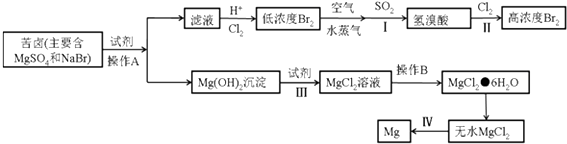
①写出下列步骤的离子方程式或化学方程式
步骤I的化学方程式: ,
步骤III的离子方程式: ,
步骤IV的化学方程式: .
②操作A是 , 操作B是 , 从步骤II得到的溶液中提取溴还需要进行的操作有:、萃取、蒸馏.
【答案】
(1)蒸馏法
(2)BD
(3)SO2+Br2+H2O══2HBr+H2SO4 ;Mg(OH)2+2H+=Mg2++2H2O;MgCl2(熔融) ![]() ?Mg+Cl2↑;过滤;冷却结晶;分液
?Mg+Cl2↑;过滤;冷却结晶;分液
【解析】解:(1)海水淡化的常用方法为:海水冻结法、电渗析法、蒸馏法、离子交换法,故答案为:海水冻结法、电渗析法、蒸馏法、离子交换法(选填其中一个);
(2.)A.通过电解熔融氯化钠得到钠和氯气,是化学变化,通过氯气将溴离子氧化为溴单质,是化学变化,故A错误;B.把海水用太阳暴晒,蒸发水分后即得食盐,不需要化学变化就能够从海水中获得,故B正确;通过电解熔融氯化钠得到钠和氯气,是化学变化,通过电解熔融的氯化镁和氧化铝即得镁和铝,是化学变化,故B正确;C.海水中氢元素为化合态,电解水生成氢气,或电解饱和食盐水生成氢气发生了化学反应,是化学变化,故C错误;D.把海水用蒸馏等方法可以得到淡水,无化学变化,故D正确;故答案为:BD;
(3.)①步骤I是二氧化硫和溴单质发生氧化还原反应生成硫酸和溴化氢,反应的化学方程式为:SO2+Br2+H2O══2HBr+H2SO4 , 故答案为:SO2+Br2+H2O══2HBr+H2SO4 ;
步骤III是氢氧化镁溶解于盐酸生成氯化镁溶液,反应的离子方程式为:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
步骤IV是电解熔融氯化镁得到金属镁和氯气,反应的化学方程式为:MgCl2(熔融) ![]() Mg+Cl2↑,故答案为:MgCl2(熔融)
Mg+Cl2↑,故答案为:MgCl2(熔融) ![]() Mg+Cl2↑;
Mg+Cl2↑;
②操作A是分离固体和溶液的操作为过滤,操作B是溶液中分离得到溶质固体的操作,通常是蒸发浓缩、冷却结晶、过滤洗涤得到氯化镁晶体,从步骤II得到的溶液中提取溴还需要进行的操作是萃取分液后蒸馏得到液溴,
故答案为:过滤,冷却结晶,分液;
(1.)根据海水淡化的常用方法:海水冻结法、电渗析法、蒸馏法、离子交换法;
(2.)从海水提物质的原理去分析,
A.海水中溴元素为离子,变化为单质需要发生化学反应;
B.海水用太阳暴晒,蒸发水分后即得食盐;
C.氢元素海水中存在是化合态,变化为氢气需要发生化学反应;
D.海水淡化是分离出纯净水,变化过程中无新物质生成,是物理变化;
(3.)苦卤中主要是硫酸镁和溴化镁,加入试剂氢氧化钙沉淀镁离子过滤得到氢氧化镁沉淀,加入试剂Ⅲ为盐酸,氢氧化镁溶解于盐酸得到氯化镁溶液,通过操作B蒸发浓缩,冷却结晶、过滤洗涤得到氯化镁晶体,在氯化氢气流中加热失去结晶水得到固体氯化镁,步骤Ⅳ是电解固体氯化镁得到金属镁和氯气,沉淀镁离子后的滤液中酸化通入氯气氧化溴离子生成溴单质,得到低浓度的溴单质溶液,用空气吹出溴单质,用二氧化硫吸收辐射氧化还原反应生成溴化氢,再通入氯气氧化溴化氢得到高浓度的溴单质,①步骤I是二氧化硫和溴单质发生氧化还原反应生成硫酸和溴化氢;步骤III是氢氧化镁溶解于盐酸生成氯化镁溶液步骤IV是电解熔融氯化镁得到金属镁和氯气;②分析可知操作A是分离固体和溶液的操作为过滤,操作B是溶液中分离得到溶质固体的操作,通常是蒸发浓缩、冷却结晶、过滤洗涤得到氯化镁晶体,从步骤II得到的溶液中提取溴还需要进行的操作是萃取分液后蒸馏得到液溴;