题目内容
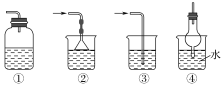
【题目】在通风橱中进行下列实验:
实验 步骤 |
|
|
|
|
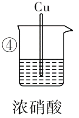
现象 | Fe表面产生大量 无色气体,在液面 上方变红棕色 | Fe表面无明 显变化 | 常温下有无色气泡,加热后,Cu表面产生无色气体,在液面上方变红棕色 | Cu表面产生红 棕色气体 |
请回答下列问题:
(1)①中气体由无色变为红棕色,红棕色气体是__________________(填分子式)。
(2)②中的现象说明Fe发生了______现象,产生的原因是________________________。
(3)对比①②中的现象,______(填“能”或“不能”)说明稀硝酸的氧化性强于浓硝酸。
(4)对比③④中的现象,说明氧化性:稀硝酸______(填“>”或“<”)浓硝酸。
(5)③中在加热时的化学反应方程式为________________________,此反应中稀硝酸除表现出氧化性外,还表现出____________。
【答案】NO2 钝化 Fe表面形成致密的氧化膜,阻止Fe进一步反应 不能 < ![]() 酸性
酸性
【解析】
(1)①中的Fe与稀硝酸发生反应:4HNO3(稀)+Fe=Fe(NO3)3+NO↑+2H2O,生成的NO在空气中被氧化2NO+O2=2NO2,生成红棕色的NO2,故红棕色气体为NO2;
(2)②中Fe表面无明显变化,说明Fe遇浓HNO3发生钝化,因为Fe遇浓HNO3后表面形成致密的氧化膜,阻止Fe与浓HNO3进一步反应;
(3)由于Fe与浓HNO3会发生钝化,不能进一步反应,所以不能比较浓HNO3和稀HNO3的氧化性;
(4)稀HNO3常温下不能与Cu反应,而浓HNO3常温下可以与Cu反应,说明稀HNO3的氧化性小于浓HNO3;
(5)Cu与稀HNO3的反应为:![]() ,稀硝酸除表现出氧化性外还起到酸性的作用。
,稀硝酸除表现出氧化性外还起到酸性的作用。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。