题目内容
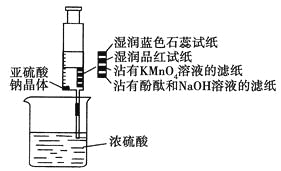
【题目】某化学实验小组同学利用以下装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
(1)实验室制备氨气的化学方程式为__。
(2)在制取氨气后,如果要干燥氨气,可选用的干燥剂是__。
A.固体氢氧化钠
B.浓硫酸
C.氯化钙
D.五氧化二磷
E.碱石灰
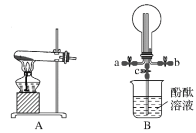
(3)用装置B收集氨气时,氨气的进气口是___(填“a”或“b”)。
(4)待圆底烧瓶中收集满氨气后,关闭a、b,打开装置B中的止水夹c,一段时间后,若观察到烧瓶内产生了红色喷泉,则说明氨气具有的性质是:___、___。
(5)以下装置(盛放的液体均为水)可用于吸收多余氨气的是__(填序号)。
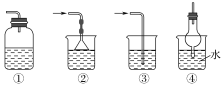
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O AE a 极易溶于水 水溶液显碱性 ②④
CaCl2+2NH3↑+2H2O AE a 极易溶于水 水溶液显碱性 ②④
【解析】
实验室加热氯化铵和熟石灰的混合物制取氨气,方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气属于碱性气体,只能用碱石灰(或烧碱、生石灰等)来干燥;氨气的密度比空气小,采用向下排气法收集氨气;氨气极易溶于水,可作喷泉实验,再用水吸收氨气时,注意防倒吸。
CaCl2+2NH3↑+2H2O;氨气属于碱性气体,只能用碱石灰(或烧碱、生石灰等)来干燥;氨气的密度比空气小,采用向下排气法收集氨气;氨气极易溶于水,可作喷泉实验,再用水吸收氨气时,注意防倒吸。
(1)实验室加热氯化铵和熟石灰的混合物制取氨气,方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,不能用浓硫酸、五氧化二磷等酸性物质干燥,且氨气可以与无水氯化钙发生反应,所以不能用无水氯化钙干燥,可用碱石灰和氢氧化钠固体干燥,所以选AE;
(3)氨气密度比空气小,应用向下排空气法收集,圆底烧瓶倒置,所以应长进短出,即a口为进气口;
(4)能够形成喷泉实验说明氨气极易溶于水这一物理性质,产生红色喷泉说明氨气水溶液显碱性;
(5)氨气极易溶于水,可用水吸收氨气,但是应该注意防止倒吸.②④都具有防倒吸功能,可以用来吸收氨气;装置①为封闭体系,当氨水达到饱和瓶内压强增大,气体无法再进入;装置③不能防止倒吸;综上所述选②④。

 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案【题目】在通风橱中进行下列实验:
实验 步骤 |
|
|
|
|
现象 | Fe表面产生大量 无色气体,在液面 上方变红棕色 | Fe表面无明 显变化 | 常温下有无色气泡,加热后,Cu表面产生无色气体,在液面上方变红棕色 | Cu表面产生红 棕色气体 |
请回答下列问题:
(1)①中气体由无色变为红棕色,红棕色气体是__________________(填分子式)。
(2)②中的现象说明Fe发生了______现象,产生的原因是________________________。
(3)对比①②中的现象,______(填“能”或“不能”)说明稀硝酸的氧化性强于浓硝酸。
(4)对比③④中的现象,说明氧化性:稀硝酸______(填“>”或“<”)浓硝酸。
(5)③中在加热时的化学反应方程式为________________________,此反应中稀硝酸除表现出氧化性外,还表现出____________。
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。