题目内容
【题目】醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如图:
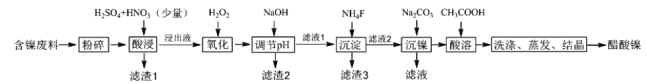
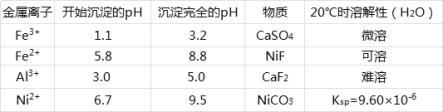
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
(1)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的离子方程式___。
(2)滤渣1和滤渣3主要成分的化学式分别是___、____。
(3)写出氧化步骤中加入过氧化氢发生反应的离子方程式______。
(4)调节pH步骤中,溶液pH的调节范围是____。
(5)沉镍过程中,若c(Ni2+)=2.0 mol/L,欲使100mL该滤液中的Ni2+沉淀完全[c(Ni2+)<10-5mol/L],则需要加入碳酸钠固体的物质的量最少为____mol。
【答案】![]()
![]()
![]()
![]()
![]() 0.296
0.296
【解析】
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎,加硫酸和硝酸酸浸,过滤,滤渣1为二氧化硅和硫酸钙,浸出液含有Ni2+、Fe2+、Al3+、Ca2+,加H2O2把亚铁离子氧化为Fe3+,然后加NaOH调节pH,使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,所以调节pH的范围5.0≤pH<6.7,过滤,滤渣2为氢氧化铁和氢氧化铝,滤液中含有Ni2+、Ca2+,再加氟化铵,生成CaF2沉淀,过滤,滤渣3为CaF2,滤液中加碳酸钠生成NiCO3沉淀,过滤,滤渣中加醋酸溶解,生成(CH3COO)2Ni溶液,然后蒸发浓缩、冷却结晶得到(CH3COO)2Ni固体,结合选项分析解答。
(1)酸浸过程中,1mol NiS被硝酸氧化失去6NA个电子,同时生成两种无色有毒气体,则生成NO和SO2,其反应的离子方程式为![]() ;
;
(2)由流程分析可知,滤渣1为![]() ,滤渣3为
,滤渣3为![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(3)调节pH使Al3+、Fe3+转化为沉淀,同时Ni2+不能转化为沉淀,根据表中的数据可知,调节pH的范围为![]() ;
;
(4)根据表格信息可知,溶液中的亚铁离子不容易转化为沉淀,加入H2O2目的是将亚铁离子氧化为Fe3+,其反应的离子方程式为:![]() ;
;
(5)已知NiCO3的Ksp=9.6×10-4,使100mL该滤液中的Ni2+沉淀物完全,即[c(Ni2+)≤10-5molL-1],则溶液中c(CO32-)=![]() =
=![]() mol/L=0.96mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+0.96mol/L×0.1L=0.296mol,故答案为:0.296。
mol/L=0.96mol/L,与Ni2+反应的n(CO32-)=cV=2mol/L×0.1L=0.2mol,则加入的碳酸钠的总物质的量n(CO32-)=0.2mol+0.96mol/L×0.1L=0.296mol,故答案为:0.296。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
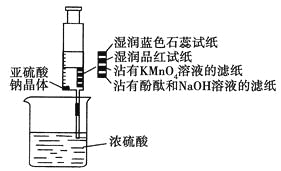
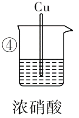
名题训练系列答案【题目】在通风橱中进行下列实验:
实验 步骤 |
|
|
|
|
现象 | Fe表面产生大量 无色气体,在液面 上方变红棕色 | Fe表面无明 显变化 | 常温下有无色气泡,加热后,Cu表面产生无色气体,在液面上方变红棕色 | Cu表面产生红 棕色气体 |
请回答下列问题:
(1)①中气体由无色变为红棕色,红棕色气体是__________________(填分子式)。
(2)②中的现象说明Fe发生了______现象,产生的原因是________________________。
(3)对比①②中的现象,______(填“能”或“不能”)说明稀硝酸的氧化性强于浓硝酸。
(4)对比③④中的现象,说明氧化性:稀硝酸______(填“>”或“<”)浓硝酸。
(5)③中在加热时的化学反应方程式为________________________,此反应中稀硝酸除表现出氧化性外,还表现出____________。
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。

(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
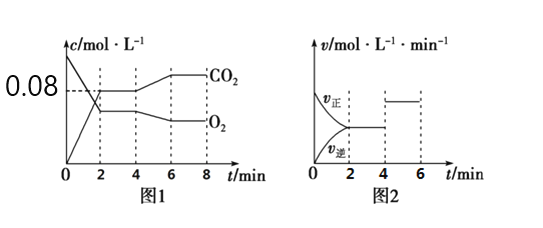
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等