题目内容
6.过氧化钙是一种重要的化工原料,温度在350℃以上容易分解.(1)利用反应Ca(s)+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2(s),在纯氧条件下,制取CaO2的装置示意图1如下:
请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;仪器a的名称为蒸馏烧瓶;
装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是防止空气进入C装置影响产品纯度.仪器安装后应进行的实验操作:
a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气
e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,
正确的操作顺序为bcaefgd.
②完全反应后,有关数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)利用反应Ca2++H2O2+2NH3•H2O+6H2O=CaO2•8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图2如下:
请回答下列问题:
①主反应中,NH3•H2O在Ca2+和H2O2的反应历程中所起的作用是中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行;该反应所需的条件及操作为acf(填字母).
a.把氯化钙溶液逐滴加入过氧化氢-氨水溶液中
b.把过氧化氢-氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热
f.反应体系冰水浴冷却
洗涤CaO2•8H2O晶体时,判断晶体是否完全洗净的试剂为AgNO3溶液;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为Ca(OH)2.
②利用反应2CaO2 >350℃?2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图3如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果偏大(填“偏大”、“偏小”或“无影响”).

分析 (1)①根据反应原理装置A为制备氧气的装置,则反应的化学方程式为2H2O2═2H2O+O2↑;仪器a的名称为蒸馏烧瓶;装置D中盛有的液体是浓硫酸,防止空气进入C装置影响产品纯度;因为过氧化钙在350℃以上容易分解,所以先通氧气后点燃酒精灯,再熄灭酒精灯,据此分析仪器安装后应进行的实验操作;
②根据数据计算理论生成产物的质量与实际比,从而结合钙的可能分析杂质;
(2)①根据平衡移动原理分析NH3•H2O在Ca2+和H2O2的反应历程中所起的作用;根据在碱性环境中,制取CaO2的流程,所以把氯化钙溶液逐滴加入过氧化氢-氨水溶液中
,因为析出的是结晶水合物,所以应静置冷却,据此分析;根据反应生成副产物为氯化铵,则通过检验氯离子即可判断晶体是否完全洗净;滤液循环使用时,则要将氯化铵转化成氯化钙和氨水,所以应加氢氧化钙;
②气体有热胀冷缩效应,刚开始温度较高的时候测量气体体积偏大.
解答 解:(1)①根据反应原理装置A为制备氧气的装置,则反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;仪器a的名称为蒸馏烧瓶;装置D中盛有的液体是浓硫酸,防止空气进入C装置影响产品纯度;因为过氧化钙在350℃以上容易分解,所以先通氧气后点燃酒精灯,再熄灭酒精灯,则仪器安装后应进行的实验操作为:bcaefgd,
故答案为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;蒸馏烧瓶;防止空气进入C装置影响产品纯度;bcaefgd;
②根据数据,则理论上生成CaO2的质量为:$\frac{15.08-14.80}{40}$×72=0.504>15.25-14.80,所以所含杂质的含钙量大于CaO2,又钙与空气中的氧气和氮气反应,所以产物中的杂质可能是CaO、Ca3N2等,
故答案为:CaO、Ca3N2等;
(2)①因为要生成多的CaO2•8H2O,则使反应不断向正反应进行,所以加NH3•H2O中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行;因为在碱性环境中,制取CaO2的流程,所以把氯化钙溶液逐滴加入过氧化氢-氨水溶液中;因为析出的是结晶水合物,所以应静置冷却,所以反应所需的条件及操作为acf;因为反应生成副产物为氯化铵,则通过检验氯离子即可判断晶体是否完全洗净,则应加AgNO3溶液;滤液循环使用时,则要将氯化铵转化成氯化钙和氨水,所以应加氢氧化钙,
故答案为:中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行;acf;AgNO3溶液; Ca(OH)2;
②气体有热胀冷缩效应,所以刚开始温度较高的时候测量气体体积偏大,
故答案为:偏大.
点评 本题考查形式为物质制备流程图题目,涉及装置的连接及化学计算等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、理解能力及化学实验、化学计算能力.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案| A. | 0.04 | B. | 0.04mol/(L.s) | C. | 0.08mol(L.s) | D. | 0.04mol/L |
(1)该反应平衡常数的表达式为K=$\frac{c{\;}^{2}(SO{\;}_{3})}{c{\;}^{2}(SO{\;}_{2})c(O{\;}_{2})}$,
T1温度下,某时刻测得体系中各物质浓度分别为c(SO2)=0.0600mol•L-1,c(O2)=0.400mol•L-1,c(SO3)=2.000mol•L-1,此时反应进行的方向为逆反应方向.
(2)该反应△S<0,升高温度,平衡常数减小(填“增大”“减小”或“不变”)
(3)T2温度下,2L容积固定的甲、乙两密闭容器中发生上述反应,测得平衡时有关数据如下:
| 容器 | 甲 | 乙 |
| 反应物投入量 | 2molSO2、1molO2 | 4molSO3 |
| 平衡时n(SO3)/mol | 1 | m |
| 反应物的转化率 | α1 | α2 |
A.SO2、O2、SO3的物质的量浓度之比为212
B.容器内气体压强不再变化
C.单位时间内生成2v(SO2)消耗=v(O2)生成
D.容器内混合气体的密度不再变化
②分析表格中数据,α1+α2< 1(填“>”“=”或“<”),T1<T2(填“>”“=”或“<”).
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 |  | 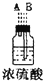 | 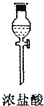 | 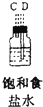 | 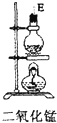 | 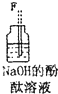 |
(1)如果所制气体从左向右流向时,上述各仪器装置的正确连接顺序是(填各装置的序号)③接⑤接④接②接①接⑥.
(2)实验开始时,应首先检查该装置的检验装置气密性;实验结束时,应先熄灭①处的酒精灯.
(3)待充分反应后,装置①的玻璃管中剩余物呈棕黄色.冷却后,将制得的产物配成饱和溶液,溶液呈绿(或蓝绿)色.
(4)装置④的作用是除去氯气中的氯化氢;装置⑥中的现象是红色逐渐褪去,发生反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)?Na2S2O3(aq) (Ⅲ)
已知:Na2S2O3•5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
(1)写出Na2S2O3溶液和稀盐酸反应的离子方程式S2O32-+2H+=SO2↑+S↓+H2O.
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若一段时间后液注高度不变,则整个装置气密性良好,装置E的作用是吸收多余的气体,防止污染空气.
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择c.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是淡黄色沉淀完全消失.
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量产品加适量蒸馏水配成稀溶液,滴加足量BaCl2溶液. | |
| 步骤2: |
| A. | 青苹果中只含有淀粉而不含单糖 | B. | 熟苹果中只含有单糖而不含淀粉 | ||
| C. | 苹果转熟时淀粉水解为单糖 | D. | 苹果转熟时单糖聚合成淀粉 |
| A. | 滴定管下端连有橡皮管的为酸式滴定管 | |
| B. | 在滴定时,左手操作锥形瓶,右手操作滴定管开关 | |
| C. | 滴定前应首先排除尖嘴部分的气泡 | |
| D. | 滴定过程中两眼应注视滴定管内液面的变化 |
 氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下:
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等.实验室制备氨基甲酸铵(NH2COONH4)的反应如下: