题目内容
13.有下列氧化还原反应:A.2F2+2H2O→4HF+O2↑ B.2Na+2H2O→2NaOH+H2↑ C.2Na2O2+2H2O→4NaOH+O2↑ D.2H2O→2H2↑+O2↑其中水是氧化剂的是B,水是还原剂的是A,水既是氧化剂,又是还原剂的是D,水既不是氧化剂,又不是还原剂的是C.(填序号)
分析 水只作氧化剂,说明水中元素只得电子化合价降低;水只作还原剂说明水中元素只失电子化合价升高;水既做氧化剂,又做还原剂说明水中元素既有得电子化合价降低的又有失电子化合价升高的;水既不是氧化剂,又不是还原剂,说明水中各元素化合价不变.
解答 解:A、2F2+2H2O=4HF+O2 中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水只作还原剂;
B、2Na+2H2O=2NaOH+H2↑中Na元素化合价由0价变为+1价、水中H元素化合价由+1价变为0价,所以水只作氧化剂;
C、2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中O元素化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,水中各元素化合价不变,则水既不是氧化剂又不是还原剂;
D、2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑中H元素化合价由+1价变为0价、O元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂;
水只做氧化剂的是B,水只做还原剂的是④;水既做氧化剂,又做还原剂的是⑥;水既不是氧化剂,又不是还原剂的是③⑤;
故答案为:B; A;D;C.
点评 本题考查氧化还原反应,侧重基本概念,明确元素化合价变化是解本题关键,熟练掌握常见元素化合价,注意氟气和水的反应、过氧化钠中O元素化合价,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
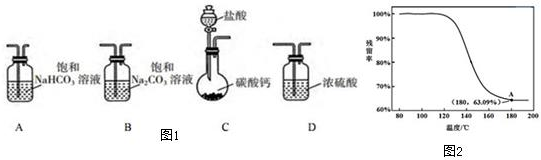
3.某学习小组利用下列装置进行CO2与饱和Na2CO3溶液反应制备NaHCO3.
(1)如图1所示,选取必要的实验装置,正确的连接顺序为CAB(填序号)
(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2 观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判定乙方案的可行性,某同学用分析纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
(Ⅰ)此实验已可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.
[已知:0.1 mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案如下:
取m克的固体样品溶解于水配成Vml的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结论是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}×100%$)
(1)如图1所示,选取必要的实验装置,正确的连接顺序为CAB(填序号)

(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:
甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2 观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案不可行(填“可行”或“不可行”)
②为判定乙方案的可行性,某同学用分析纯净的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下:
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑池 | 无现籴 |
| 0.02mol•L-1 | 少许浑油 | 尤现象 | 尤现象 |
[已知:0.1 mol•L-1NaHC03溶液电离出的c(CO32-)为0.0011mol•L-1,Ksp(BaCO3)=5.1×10-9]
答:Qc=c(Ba2+)×c(CO32-)=$\frac{0.2}{2}$×0.0011=1.1×10-4>5.1×10-9.
(Ⅱ)产生浑浊的离子方程式为Ba2++2HCO3-=BaCO3↓+CO2↑+H2O.
③使用pH计进行测定的丙方案如下:
取m克的固体样品溶解于水配成Vml的溶液,用pH计测pH:
还应补充的实验是:另取等质量的分析纯NaHC03溶于水中配成V mL的溶液,用pH计测pH
④进行丁方案实验,得到固体残留率随温度变化的曲线如图2所示,根据A点坐标得到的结论是制得的固体样品是纯净的NaHCO3.
(残留率=$\frac{剩余固体的质量}{原始固体的质量}×100%$)
4.下列哪组溶液混合后最先出现浑浊的是( )
| 编号 | H2SO4 | Na2S2O3 | H2O(ml) |
| A | 5ml 0.1mol/L | 5ml 0.1mol/L | 0 |
| B | 5ml 0.2mol/L | 5ml 0.1mol/L | 10 |
| C | 5ml 0.3mol/L | 5ml 0.1mol/L | 20 |
| D | 5ml 0.4mol/L | 5ml 0.1mol/L | 30 |
| A. | A | B. | B | C. | C | D. | D |
1.漆酚( )是我国特产漆的主要成分,黄色能溶于有机溶剂中,生漆涂在物质表面,能在空气中干燥为黑色漆膜,对它的性质描述错误的是( )
)是我国特产漆的主要成分,黄色能溶于有机溶剂中,生漆涂在物质表面,能在空气中干燥为黑色漆膜,对它的性质描述错误的是( )
 )是我国特产漆的主要成分,黄色能溶于有机溶剂中,生漆涂在物质表面,能在空气中干燥为黑色漆膜,对它的性质描述错误的是( )
)是我国特产漆的主要成分,黄色能溶于有机溶剂中,生漆涂在物质表面,能在空气中干燥为黑色漆膜,对它的性质描述错误的是( )| A. | 可能与溴发生加成反应 | B. | 能使酸性KMnO4溶液褪色 | ||
| C. | 与NaHCO3反应放出CO2气体 | D. | 可以与烧碱溶液反应 |
18.在恒温恒容的容器中进行反应H2?2H;△H>0,若反应物浓度由0.1mol•L-1降到0.06mol•L-1需20s,那么由0.06mol•L-1降到0.024mol•L-1需要的反应时间为( )
| A. | 等于18s | B. | 等于 12s | C. | 大于18s | D. | 小于18s |
5.下列各组物质中,按熔点由高到低的顺序排列正确的是( )
| A. | H2O、H2S、H2Se | B. | Hg、Na、NaCl | ||
| C. | 晶体硅、金刚石、碳化硅 | D. | S、Br2、O3 |
6.过氧化钙是一种重要的化工原料,温度在350℃以上容易分解.
(1)利用反应Ca(s)+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2(s),在纯氧条件下,制取CaO2的装置示意图1如下:
请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;仪器a的名称为蒸馏烧瓶;
装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是防止空气进入C装置影响产品纯度.仪器安装后应进行的实验操作:
a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气
e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,
正确的操作顺序为bcaefgd.
②完全反应后,有关数据记录如下:
据此可判断m2与理论值不符,则产物中的杂质可能是CaO、Ca3N2等.
(2)利用反应Ca2++H2O2+2NH3•H2O+6H2O=CaO2•8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图2如下:
请回答下列问题:
①主反应中,NH3•H2O在Ca2+和H2O2的反应历程中所起的作用是中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行;该反应所需的条件及操作为acf(填字母).
a.把氯化钙溶液逐滴加入过氧化氢-氨水溶液中
b.把过氧化氢-氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热
f.反应体系冰水浴冷却
洗涤CaO2•8H2O晶体时,判断晶体是否完全洗净的试剂为AgNO3溶液;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为Ca(OH)2.
②利用反应2CaO2 >350℃?2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图3如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果偏大(填“偏大”、“偏小”或“无影响”).

(1)利用反应Ca(s)+O2$\frac{\underline{\;\;△\;\;}}{\;}$CaO2(s),在纯氧条件下,制取CaO2的装置示意图1如下:
请回答下列问题:
①装置A中反应的化学方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;仪器a的名称为蒸馏烧瓶;
装置D中盛有的液体是浓硫酸,其作用一是观察氧气的流速,判断氧气通入是否过快及氧气与钙反应进行的程度;二是防止空气进入C装置影响产品纯度.仪器安装后应进行的实验操作:
a.通入氧气 b.检查装置气密性 c.加入药品 d.停止通氧气
e.点燃酒精灯 f.熄灭酒精灯 g.冷却至室温,
正确的操作顺序为bcaefgd.
②完全反应后,有关数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.25 |
(2)利用反应Ca2++H2O2+2NH3•H2O+6H2O=CaO2•8H2O+2NH4+,在碱性环境中,制取CaO2的流程示意图2如下:
请回答下列问题:
①主反应中,NH3•H2O在Ca2+和H2O2的反应历程中所起的作用是中和过氧化氢和Ca2+反应析出的氢离子,促进反应进行;该反应所需的条件及操作为acf(填字母).
a.把氯化钙溶液逐滴加入过氧化氢-氨水溶液中
b.把过氧化氢-氨水溶液逐滴加入氯化钙溶液中
c.滴加时先搅拌后静置,观察晶体析出
d.滴加时不停搅拌,直至晶体完全析出
e.反应体系热水浴加热
f.反应体系冰水浴冷却
洗涤CaO2•8H2O晶体时,判断晶体是否完全洗净的试剂为AgNO3溶液;滤液循环使用时需在反应器中加入一种物质,该物质的化学式为Ca(OH)2.
②利用反应2CaO2 >350℃?2CaO+O2↑测量产品中CaO2含量时,停止反应且冷却至25℃后的装置示意图3如下:若直接读数确定25℃、1大气压下气体的体积,则测量结果偏大(填“偏大”、“偏小”或“无影响”).

7.在恒温、恒容的密闭容器中反应.若反应物的浓度由2mol/L降到0.8mol/L需20s,那么反应物浓度由2mol/L降到1.4mol/L所需的时间( )
| A. | 10s | B. | 大于10s | C. | 小于10s | D. | 无法判断 |
 ③氧气 ④氯气 ⑤
③氧气 ④氯气 ⑤ ⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧臭氧.
⑥${\;}_{17}^{37}$Cl ⑦${\;}_{17}^{35}$Cl ⑧臭氧.