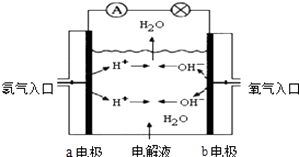
题目内容
【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g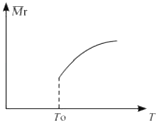
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .
【答案】
(1)0.015mol/(L.min)
(2)B
(3)T3;0≤x<0.15
(4)24.22%
(5)SiO2(s)+2C(s)+2Cl2(g)═SiCl4(g)+2CO(g)△=(a+b﹣c)KJ/mol
【解析】解:(1)固体的质量增加了2.80g为Si3N4的质量,其物质的量 ![]() =0.02mol,根据方程式可知消耗SiCl4的物质的量=0.02mol×3=0.06mol,故v(SiCl4)=
=0.02mol,根据方程式可知消耗SiCl4的物质的量=0.02mol×3=0.06mol,故v(SiCl4)= ![]() =0.015mol/(L.min),
=0.015mol/(L.min),
所以答案是:0.015mol/(L.min);(2)A.由图可知,随温度升高,气体的平均相对分子质量增大,说明正反应为放热反应,即△H<0,反应的△S>0,△H﹣T△S<0时反应能够自发进行,所以任何温度下反应都能够自发进行,故A正确;
B.Si3N4是固体,随反应进行混合气体的总质量减小,若混合气体的总质量不变,表明上述反应己达到平衡状态,故B正确;
C.Si3N4是固体,增大其物质的量,不影响平衡移动,故C错误;
D.按3:2:6的物质的量比增加反应物,相当于增大氢气浓度,SiCl4(g)的转化率升高,故D错误;
所以答案是:AB;(3)正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,故温度T1>T2>T3 , 温度越低,反应速率越慢,到达平衡时间越长,即温度T3达到平衡时间最长;Q= ![]() <K=1.2时,平衡逆向移动,0≤x<0.15时符合,所以答案是:T3;0≤x<0.15;(4)原子利用率=(目标产物总量/按化学方程式计算生成物总量)×100%,故该反应原子利用率=[(28×3+14×4)÷(28×3+14×4+36.6×12)]×100%=24.22%,
<K=1.2时,平衡逆向移动,0≤x<0.15时符合,所以答案是:T3;0≤x<0.15;(4)原子利用率=(目标产物总量/按化学方程式计算生成物总量)×100%,故该反应原子利用率=[(28×3+14×4)÷(28×3+14×4+36.6×12)]×100%=24.22%,
所以答案是:24.22%;(5)已知
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
据盖斯定律,①+②﹣③得:SiO2(s)+2C(s)+2Cl2(g)═SiCl4(g)+2CO(g)△=(a+b﹣c)KJ/mol,所以答案是:SiO2(s)+2C(s)+2Cl2(g)═SiCl4(g)+2CO(g)△=(a+b﹣c)KJ/mol.
【考点精析】掌握反应速率的定量表示方法和化学平衡状态的判断是解答本题的根本,需要知道反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t;状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

【题目】甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
CO(g)+ 2H2(g)![]() CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)已知: ![]() △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
![]() △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式:________________
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是________________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)![]() CH3OH(g)的平衡常数 K=_________。
CH3OH(g)的平衡常数 K=_________。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度 (molL-1)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是_________________________。