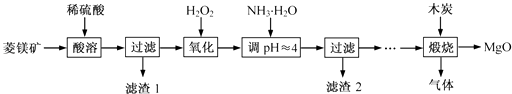
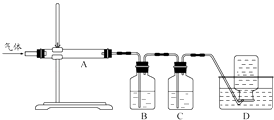
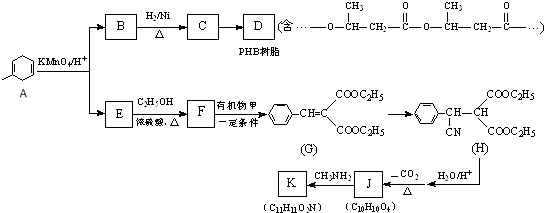
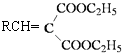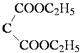题目内容
【题目】质量反应的离子方程式书写正确的是( )
A.氢氧化镁与稀盐酸反应:H++OH﹣═H2O
B.氯化钡溶液与硫酸钠溶液反应:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
C.FeCl3溶液中加入Fe粉:Fe3++Fe═2Fe2+
D.碳酸钠溶液与足量醋酸反应:Na2CO3+2H+═2Na++CO2↑+H20
【答案】B
【解析】解:A.氢氧化镁为难溶物质,则氢氧化镁与稀盐酸反应:2H++Mg(OH)2═Mg2++2H2O,故A错误;B.氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀,其反应的离子方程式为:Ba2++SO ![]() ═BaSO4↓,故B正确;
═BaSO4↓,故B正确;
C.FeCl3溶液中加入Fe粉:2Fe3++Fe═3Fe2+ , 故C错误;
D.碳酸钠溶液与足量醋酸反应:CO ![]() +2CH3COOH→2CH3COO﹣+CO2↑+H20,故D错误.
+2CH3COOH→2CH3COO﹣+CO2↑+H20,故D错误.
故选B.

【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g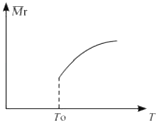
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .