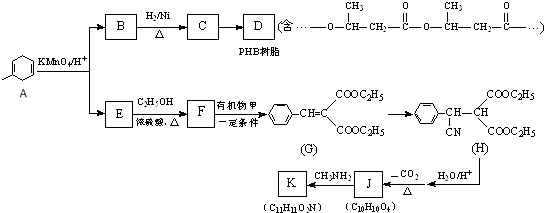
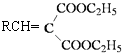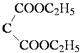题目内容
【题目】下列离子方程式书写正确的是( )
A.烧碱溶液与小苏打溶液反应:OH﹣+HCO ![]() ═H2O+CO2↑
═H2O+CO2↑
B.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++H2O+CO2
C.向H2O中加入少量Na2O2 , 产生无色气体:2Na2O2+2H2O═O2↑+4OH﹣+4Na+
D.向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色:Fe2++Cl2═Fe3++2Cl﹣
【答案】C
【解析】解:A.烧碱溶液与小苏打溶液反应生成碳酸钠和水,离子方程式:OH﹣+HCO ![]() ═H2O+CO
═H2O+CO ![]() ,故A错误; B.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO﹣ , 故B错误;
,故A错误; B.碳酸钙溶于醋酸,离子方程式:CaCO3+2CH3COOH═Ca2++H2O+CO2↑+2CH3COO﹣ , 故B错误;
C.向H2O中加入少量Na2O2 , 产生无色气体,离子方程式:2Na2O2+2H2O═O2↑+4OH﹣+4Na+ , 故C正确;
D.向Cl2水中滴入适量FeCl2 溶液,溶液变为黄色,离子方程式:2Fe2++Cl2═2Fe3++2Cl﹣ , 故D错误;
故选:C.

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g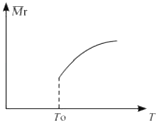
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .