��Ŀ����
����Ŀ��﮿�����ر�����ӵ�ؾ��и��ߵ������ܶȣ�ǰ���dz���������ṹ������ԭ����ͼ��������Һֻ����Li+ͨ�����������й�˵������ȷ���ǣ� �� 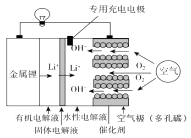
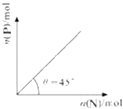
A.��ع���ʱ��������Ӧʽ��O2+2H2O+4e��=4OH��
B.ȥ��������Һ���л�����ʣ���ط�Ӧ�����ı�
C.���ʱ������14 g Li����������������16 g
D.���ʱ��ר�ó��缫������Ч��ֹ��������ʴ���ӻ�
���𰸡�C
���������⣺A����Ϊ�õ��Ϊˮ�Ե��Һ���������������õ��ӵĻ�ԭ��Ӧ����ӦΪO2+2H2O+4e��=4OH�� �� ��A��ȷ��
B���缫��Ӧ�͵���ʻ����йأ�ȥ��������Һ���л�����ʣ���ط�Ӧ�����ı䣬��B��ȷ��
C�����ʱ������14 g Li��ת��2mol���ӣ��������������õ��ӵĻ�ԭ��Ӧ����ӦΪO2+2H2O+4e��=4OH�� �� ��������������34 g���������ӣ���C����
D�����ʱ����ϵ�صĹ����ԭ��������ר�ó��缫������Ч��ֹ��������ʴ����D��ȷ��
��ѡC��

����Ŀ���õ������մɴ���������췢���������Ȳ������ܴ������߷���������Ч�ʣ���ҵ���û�ѧ����������Ʊ������裬�䷴Ӧ���£�3SiCl4��g��+2N2��g��+6H2��g��![]() Si3N4��s��+12HCl��g�����¶�T0�µ�2L�ܱ������У�����0.30mol SiCl4 �� 0.20mol N2.0.36mol H2����������Ӧ��2min��ﵽƽ�⣬��ù��������������2.80g
Si3N4��s��+12HCl��g�����¶�T0�µ�2L�ܱ������У�����0.30mol SiCl4 �� 0.20mol N2.0.36mol H2����������Ӧ��2min��ﵽƽ�⣬��ù��������������2.80g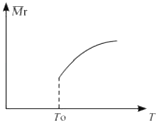
��1��SiCl4��ƽ����Ӧ����Ϊ
��2��ƽ������ı��¶ȣ���������ƽ����Է����������¶ȵĹ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� ��
A.�÷�Ӧ���κ��¶��¿��Է�����
B.�������������������䣬����������Ӧ���ﵽƽ��״̬
C.�����������䣬����Si3N4�����ʵ�����ƽ�������ƶ�
D.��3��2��6�����ʵ��������ӷ�Ӧ�SiCl4��g����ת���ʽ���
��3���±�Ϊ��ͬ�¶��¸÷�Ӧ��ƽ�ⳣ��������������ͬʱ�������T1������T2������T3�����¶��·�Ӧ�ﵽƽ������ʱ�����
�¶�T | T1 | T2 | T3 |
ƽ�ⳣ��K | 1.2 | 2.5 | 10 |
�����¶�ΪT1ʱ��÷�Ӧ������ͬʱ���룮c��SiCl4��=0.3mol/L��c��H2��=0.3mol/L��c��N2��=x mol/L��c��HCl��=0.3mol/L������Si3N4 ��s������Ҫʹƽ�⽨���Ĺ�����HClŨ�ȼ�С��x��ȡֵ��ΧΪ
��4���÷�Ӧ��ԭ��������Ϊ
��5����ҵ���Ʊ�SiCl4�ķ�Ӧ�������£�
��SiO2��s��+2C��s���TSi��s��+2CO��g������H�TakJ/mol
��Si��s��+2Cl2��g���TSiCl4��l������H=bkJ/mol
��SiCl4��g���TSiCl4��l������H�TckJ/mol
д���������衢��̿��Cl 2�ڸ����·�Ӧ������̬SiCl4��һ����̼���Ȼ�ѧ����ʽ ��