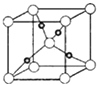
题目内容
【题目】图为氢氧燃料电池原理示意图,按照此图的提示,回答以下问题: 
(1)下列叙述不正确的是 A a电极是负极
B b电极的电极反应为:4OH﹣﹣4e﹣=2H2O+O2↑
C 氢氧燃料电池是一种具有应用前景的绿色电源
D 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)若电解质溶液为KOH溶液,则电极反应式为:a极b极
(3)若电解质溶液为稀H2SO4 , 则电极反应式为:a极b极
【答案】
(1)B
(2)2H2﹣4e﹣+4OH﹣=4H2O;O2+2H2O+4e﹣=4OH﹣
(3)2H2﹣4e﹣=4H+;O2+4H++4e﹣=2H2O
【解析】解:(1)A、氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的a极为电源的负极,故A正确; B、氢氧燃料电池中,通入氧气的b极为原电池的正极,正极上氧气得电子发生还原反应,要根据电解质溶液的酸碱性确定其电极反应式,故B错误;
C、氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,故C正确;
D、氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,故D正确.
故选B;(2)当电解质是碱时,氢气失电子生成的氢离子在碱性溶液中不能稳定存在,它和氢氧根离子反应生成水,所以负极上发生的电极反应是氢气失电子和氢氧根离子生成水,即电极反应式为2H2﹣4e﹣+4OH﹣=4H2O;正极上氧气得电子和水生成氢氧根离子,所以其电极反应式为 O2+2H2O+4e﹣=4OH﹣ ,
所以答案是:2H2﹣4e﹣+4OH﹣=4H2O;O2+2H2O+4e﹣=4OH﹣;(3)负极上失电子发生氧化反应,电解质是酸,所以负极上氢气失电子后生成的微粒是氢离子,故其电极反应式为:2H2﹣4e﹣=4H+;正极上氧气得电子和氢离子反应生成水,发生还原反应,故其电极反应式为:O2+4H++4e﹣=2H2O,
所以答案是:2H2﹣4e﹣=4H+;O2+4H++4 e﹣=2H2O.

【题目】用氮化硅陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,其反应如下:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g
Si3N4(s)+12HCl(g)在温度T0下的2L密闭容器中,加入0.30mol SiCl4 , 0.20mol N2.0.36mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80g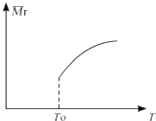
(1)SiCl4的平均反应速率为
(2)平衡后,若改变温度,混合气体的平均相对分子质量与温度的关系如图所示,下列说法正确的是( )
A.该反应在任何温度下可自发进行
B.若混合气体的总质量不变,表明上述反应己达到平衡状态
C.其他条件不变,增大Si3N4的物质的量,平衡向左移动
D.按3:2:6的物质的量比增加反应物,SiCl4(g)的转化率降低
(3)下表为不同温度下该反应的平衡常数,其他条件相同时,在(填“T1”、“T2”、“T3”)温度下反应达到平衡所需时间最长:
温度T | T1 | T2 | T3 |
平衡常数K | 1.2 | 2.5 | 10 |
假设温度为T1时向该反应容器中同时加入.c(SiCl4)=0.3mol/L,c(H2)=0.3mol/L,c(N2)=x mol/L,c(HCl)=0.3mol/L和足量Si3N4 (s),若要使平衡建立的过程中HCl浓度减小,x的取值范围为
(4)该反应的原子利用率为
(5)工业上制备SiCl4的反应过程如下:
①SiO2(s)+2C(s)═Si(s)+2CO(g),△H═akJ/mol
②Si(s)+2Cl2(g)═SiCl4(l),△H=bkJ/mol
③SiCl4(g)═SiCl4(l),△H═ckJ/mol
写出二氧化硅、焦炭与Cl 2在高温下反应生成气态SiCl4和一氧化碳的热化学方程式 .