��Ŀ����
3��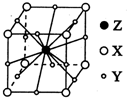 X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ�Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Z�ĵ����������ȷ�Ӧ����ȼ���� W��X�γɵĻ�������һ�ֳ������л��ܼ�n��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ�
X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ�Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Z�ĵ����������ȷ�Ӧ����ȼ���� W��X�γɵĻ�������һ�ֳ������л��ܼ�n��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ���ش��������⣺
��1��X��Ԫ�����ڱ��е�λ���ǵڶ����ڢ�A�壮
��2��A3+����Χ�����Ų�ʽ��3d3��
��3��X��Y��Z�γɵľ����ṹʾ��ͼ���ң������Ļ�ѧʽ��MgCO3��
��4��m�����У�X��ԭ�ӹ���ӻ�������sp��n�ķ��ӹ������������壮
��5������m�ͺ�A2Y${\;}_{7}^{2-}$��������Һ����ͨ�����Ե缫���ӹ��ɸ���ԭ��أ��õ�ص�������Ӧʽ��Cr2O72-+14H++6e-=2Cr3++7H2O��
���� X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ���XΪCԪ�أ�mΪC2H2��Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Yԭ�Ӻ��������Ϊ2+8-2=6����YΪOԪ�أ�Z�ĵ����������ȷ�Ӧ����ȼ������ZΪMg�� W��X�γɵĻ�������һ�ֳ������л��ܼ�n����WΪCl��nΪCCl4��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ���������Ų�Ϊ1s22s22p63s23p63d54s1����AΪCr���ݴ˽��
��� �⣺X��Y��Z��WΪ������Ԫ����ԭ��������������X��һ����̬�⻯��m���������ӻ��и�������Ҹ÷�������ԭ����һ��ֱ���ϣ���XΪCԪ�أ�mΪC2H2��Y2-��M�ܲ��ԭ�ӹ��Ϊȫ��״̬��Yԭ�Ӻ��������Ϊ2+8-2=6����YΪOԪ�أ�Z�ĵ����������ȷ�Ӧ����ȼ������ZΪMg�� W��X�γɵĻ�������һ�ֳ������л��ܼ�n����WΪCl��nΪCCl4��AΪ��������Ԫ�أ����̬ԭ�Ӻ���6��δ�ɶԵ��ӣ���������Ų�Ϊ1s22s22p63s23p63d54s1����AΪCr��
��1��XΪCԪ�أ���Ԫ�����ڱ��е�λ���ǣ��ڶ����ڢ�A�壬�ʴ�Ϊ���ڶ����ڢ�A�壻
��2��Crԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d54s1��Cr3+����Χ�����Ų�ʽ��3d3���ʴ�Ϊ��3d3��
��3��������̼ԭ����ĿΪ8��$\frac{1}{8}$=1����ԭ����ĿΪ12��$\frac{1}{4}$=3��Mgԭ����ĿΪ1���ʸû����ﻯѧʽΪMgCO3���ʴ�Ϊ��MgCO3��
��4��mΪC2H2���ṹ��ʽΪH-C��C-H��������C��ԭ�ӳ�2���Ҽ���û�й¶Ե��ӣ�Cԭ�Ӳ�ȡsp�ӻ���nΪCCl4��Ϊ��������ṹ���ʴ�Ϊ��sp���������壻
��5������C2H2�ͺ�Cr2O72-��������Һ����ͨ�����Ե缫���ӹ��ɸ���ԭ��أ�����������ԭ��Ӧ��Cr2O72-��������õ��ӣ���������������Cr3+��ˮ���õ�ص�������Ӧʽ�ǣ�Cr2O72-+14H++6e-=2Cr3++7H2O���ʴ�Ϊ��Cr2O72-+14H++6e-=2Cr3++7H2O��
���� �����Ƕ����ʽṹ�Ŀ��飬�漰Ԫ�ػ������ƶϡ���������Ų����������㡢�ӻ�����������ṹ���缫��Ӧʽ��д�ȣ���Ҫѧ���߱���ʵ�Ļ������Ѷ��еȣ�

| A�� | 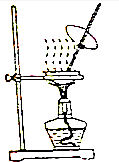 ����������FeCl3 ��Һ��ô�FeCl3 ���� | |
| B�� |  ���������ſ������ռ�CO2��NO ������ | |
| C�� | 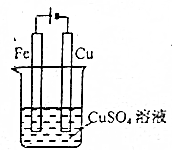 ����ʵ���������϶���һ��ͭ | |
| D�� |  ���Գ�ȥCl2�л��е�HCl |
| A�� | ��ܵĴ�С�Ի�ѧ��Ӧǰ��������仯������Ӱ�� | |
| B�� | ��ѧ���Ķ��Ѻ��γ��������ڻ�ѧ�仯�з��������仯����Ҫԭ�� | |
| C�� | �����NaOH��aq����Ӧ���к��ȡ�H=-57.3kJ/mol����H2SO4��aq����Ca��OH��2��aq����Ӧ���к��ȡ�H=2����-57.3��kJ/mol | |
| D�� | CO��g����ȼ������283.0kJ/mol����Ӧ2CO2��g��=2CO��g��+O2��g���ķ�Ӧ�ȡ�H=+2 x283.0kJ/mol |
| A�� | 1��1 | B�� | 1��2 | C�� | 2��11 | D�� | 4��1 |
��1��C��s��+O2��g���TCO2��g����H1=-393.5kJ•mol-1
��2��H2��g��+$\frac{1}{2}$O2��g���TH2O��l����H2=-285.8kJ•mol-1
��3��CH3COOH��l��+2O2��g���T2CO2��g��+2H2O��l����H3=-870.3kJ•mol-1
�������Ϸ���ʽ���Լ����2C��s��+2H2��g��+O2��g���TCH3COOH��l���ķ�Ӧ��Ϊ��������
| A�� | +244.1 kJ•mol-1 | B�� | -488.3 kJ•mol-1 | C�� | -996.6 kJ•mol-1 | D�� | +996.6 kJ•mol-1 |
| A�� | C6H12O6��s��+6O2��g��=6CO2��g��+6H2O��l����H1 | B�� | S��s��+3/2O2��g��=SO3��s����H2 | ||
| C�� | CH4��g��+2O2��g��=2H2O��l��+CO��g����H3 | D�� | 2CO��g��+O2��g��=CO2��g����H4 |
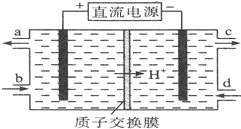 �����ᣨHN02���ڹ�ҵ�������л��ϳɣ��Ⱦ����������־��л�ԭ�ԣ����������ԱȻ�ԭ��ͻ���ö࣮�ش��������⣺
�����ᣨHN02���ڹ�ҵ�������л��ϳɣ��Ⱦ����������־��л�ԭ�ԣ����������ԱȻ�ԭ��ͻ���ö࣮�ش��������⣺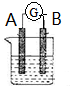 ��ͼ��ʾΪԭ���װ��ʾ��ͼ��
��ͼ��ʾΪԭ���װ��ʾ��ͼ��