题目内容
14.下列有关实验装置进行的相应实验,能达到实验目的是( )| A. | 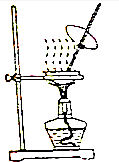 可用来蒸发FeCl3 溶液获得纯FeCl3 固体 | |
| B. |  可用向上排空气法收集CO2、NO 等气体 | |
| C. | 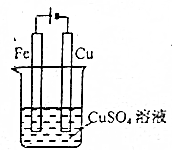 可以实现在铁棒上镀上一层铜 | |
| D. | 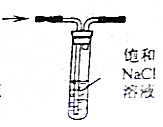 可以除去Cl2中混有的HCl |
分析 A.氯化铁属于强酸弱碱盐,其水解生成盐酸,且盐酸具有挥发性,加热促进水解;
B.NO易和氧气反应生成二氧化氮,不能用排空气法收集;
C.电镀时,镀层作阳极、镀件作阴极;
D.HCl极易溶于水,氯气能溶于水,但不易溶于NaCl溶液.
解答 解:A.氯化铁属于强酸弱碱盐,其水解生成盐酸,且盐酸具有挥发性,加热促进水解且促进盐酸挥发,蒸干时得不到氯化铁而是氢氧化铁,在HCl氛围中蒸发氯化铁溶液得到氯化铁固体,故A错误;
B.NO易和氧气反应生成二氧化氮,不能用排空气法收集,NO不易溶于水,应该采用排水法收集NO,故B错误;
C.电镀时,镀层作阳极、镀件作阴极,所以Cu作阳极、Fe作阴极,故C错误;
D.HCl极易溶于水,氯气能溶于水,氯气和水反应生成盐酸和次氯酸,氯离子抑制氯气水解,所以氯气不易溶于NaCl溶液,可以采用排饱和食盐水方法除去氯气中HCl,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高考高频点,涉及盐类水解、气体收集、电镀、除杂等知识点,明确实验原理是解本题关键,会从物质性质及操作方面进行评价,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
4.太阳能电池已为人们所熟悉,制造太阳能电池板的核心体材料是( )


| A. | 二氧化硅 | B. | 硅 | C. | 钛合金 | D. | 铝合金 |
5.下列叙述正确的是( )
| A. | 制备乙酸乙酯时可用热的NaOH代替饱和NaHCO3溶液来除去其中的乙酸 | |
| B. | SO2使酸性KMnO4溶液褪色与乙烯使溴水褪色的原理相同 | |
| C. | 可用CuSO4溶液除去制乙炔时混有的杂质H2S | |
| D. | 在AgI饱和溶液中加入KCl固体可产生白色沉淀,说明Ksp(AgCl)<Ksp(AgI) |
6.实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
今若制得Cl2 0.10mol,这时电池内消耗的H2SO4的物质的量至少是( )
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.10 mol | D. | 0.20 mol |
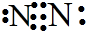 和结构式N≡N.
和结构式N≡N.
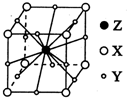 X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.
X、Y、Z、W为短周期元素且原子序数依次增大.X的一种气态氢化物m可用来焊接或切割金属,且该分子所有原子在一条直线上.Y2-的M能层的原子轨道为全空状态.Z的单质用作铝热反应的引燃剂. W与X形成的化合物是一种常见的有机溶剂n.A为第四周期元素,其基态原子含有6个未成对电子.