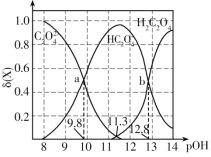
题目内容
【题目】同温、同压下,等体积的NH3和CH4两种气体,下列有关说法错误的是()
A.所含分子数目相同B.质量之比为16:17
C.所含氢原子物质的量之比为3:4D.密度之比为17:16
【答案】B
【解析】
由阿伏加德罗定律及推论可知:同温、同压下,等体积的NH3和CH4的物质的量相等,分子数相等,据此解答。
A.阿伏加德罗定律:同温、同压下,等体积的气体具有相同的分子数,故A正确;
B.NH3和CH4的物质的量相等,则m(NH3):m(CH4)=M(NH3):M(CH4)=17:16,故B错误;
C.NH3和CH4的物质的量相等,则所含氢原子物质的量之比=3:4,故C正确;
D.ρ(NH3):ρ(CH4)=![]() =17:16,故D正确。
=17:16,故D正确。
答案选B。

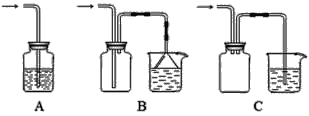
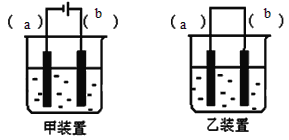
【题目】乙酸乙酯是无色、具有果香气味的液体。某同学采用12.0mL96%密度为1.05g/mL的乙酸、23mL95%密度为0.75g/mL的乙醇、12.0mL浓硫酸、饱和Na2CO3溶液制备乙酸乙酯,其实验装置如图所示(烧杯、部分夹持装置、温度计已略去)。
已知:①氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77.2 |

①先向蒸馏烧瓶B中加入试剂__,然后通过仪器A慢慢加入__;
②加热保持油浴温度为135~145℃,至不再有液体流出后,停止加热;
③取带有支管的锥形瓶,将一定量的饱和Na2CO3溶液分批、少量、多次地加入馏出液中,再将混合物分液,弃去水层,得到有机层。
试回答下列问题:
(1)①蒸馏烧瓶B加入试剂__,然后通过仪器A慢慢加入__。
(2)写出制备乙酸乙酯的化学方程式__。
(3)仪器A的名称是__;浓硫酸的作用是__;仪器C的作用是__。
(4)反应中所用的乙醇是过量的,其目的是__。
(5)③中加入饱和碳酸钠溶液的作用__,分批、少量、多次地加入饱和碳酸钠的原因是__。
(6)从③中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入饱和氯化钙溶液分离出__,再加入无水硫酸钠,然后进行蒸馏,收集77.2℃的馏分,以得到纯净的乙酸乙酯9.2g,计算此实验中生成乙酸乙酯的产率为__(写出计算的表达式)。
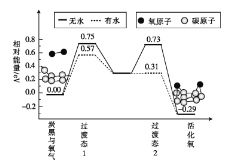
【题目】I. 合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)已知:5.6L(标况下)CH4与水蒸气完全反应,吸收51.5KJ的热量,请写出该反应的热化学方程式_______________________________________________。
(2)在150℃时2L的密闭容器中,将2 mol CH4和2 mol H2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=____________。
②在该温度下,计算该反应的平衡常数K=________________________(保留两位小数)。
③下列选项中能表示该反应已达到平衡状态的是__________________________
A.v(H2)逆=3v (CO)正 B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变 D.C (CH4) = C (CO)
(3)合成气中的氢气也用于合成氨气:N2 + 3H2![]() 2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
2NH3。保持温度和体积不变, 在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是___________。
容 器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1 mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2 mol | φ丙 | ν丙 | P丙 |
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
II.(1)常温下,在x mol·L-1氨水中加入等体积的y mol·L-1硫酸得混合溶液M恰好显中性。
①M溶液中所有离子浓度由大到小的顺序为_________________。
②常温下,NH3·H2O的电离常数K=_____(用含x和y的代数式表示,忽略溶液混合前后的体积变化)。
(2)利用电解法处理高温空气中稀薄的NO(O2浓度约为NO浓度的10倍),装置示意图如下,固体电解质可传导O2-
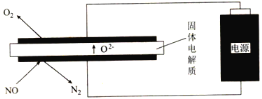
阴极的电极反应式为___________________________。
②消除一定量的NO所消耗的电量远远大于理论计算量,可能的原因是(不考虑物理因素)________。