��Ŀ����
����Ŀ��ij���γ�������Cr(��)��ˮ����ȡCr2O3��һ�ֹ���������ͼ��ʾ��
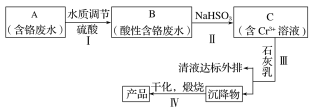
��֪��Ksp[Cr(OH)3]��6.3��10��31
Ksp[Fe(OH)3]��2.6��10��39
Ksp[Fe(OH)2]��4.9��10��17
��1��������У������ķ�ӦΪ2H����2CrO42-![]() Cr2O72-��H2O��B�к���Ԫ�ص�������___(�����ӷ���)��
Cr2O72-��H2O��B�к���Ԫ�ص�������___(�����ӷ���)��
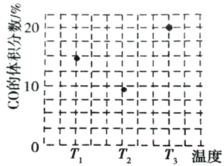
��2������Һ��Cr3����Ũ�ȡ�1.5mg��L��1ʱ������Ϊ�Ѵ�����ŷű����������Һ��pH��5������Һ�в����ϸ����ŷű�����Ϊ��ʱCr3����Ũ�ȣ�__mg��L��1��
��3����������������ʴ���NaHSO3����ԭ����
������FeSO4��7H2O����ԭ����������вμӷ�Ӧ��������һ����__(�����ӷ���)��
��������м����ԭ����������Ͷ������ͬʱ�������㣬C��Һ��pH��c(Cr2O72-)�Ķ�Ӧ��ϵ���±���ʾ��
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol��L��1 | 7.02��10��21 | 7.02��10��7 | 1.25��10��3 | 2.21��10��34 |
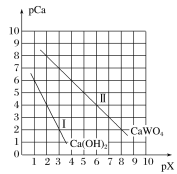
������ΪpH��6ʱ��c(Cr2O72-)��С��ԭ����Cr2O72-�����϶���ת��ΪCr3��������˵���Ƿ���ȷ��Ϊʲô��___��
������м����ԭ��ʱ��Ϊʹ���ò�Ʒ�к���Ԫ�����ʵĺ��������ܵͣ���Ҫ���Ƶ�������___��
���𰸡�CrO42-��Cr2O72- 32.76 Cr3����Fe3����H�� ����ȷ��c(H��)��С����ѧƽ��2H����2CrO42-![]() Cr2O72-��H2O���淴Ӧ�����ƶ�����Һ��Cr(��)��Ҫ��CrO42-��ʽ���� ��м����������Һ��pH������ʹCr3����ȫ������Fe2���������ķ�Χ��
Cr2O72-��H2O���淴Ӧ�����ƶ�����Һ��Cr(��)��Ҫ��CrO42-��ʽ���� ��м����������Һ��pH������ʹCr3����ȫ������Fe2���������ķ�Χ��
��������
���ݻ�ѧƽ��״̬���������з����������ܶȻ��ı���ʽ������ؼ�����жϡ�
(1)������У������ķ�ӦΪ2H����2CrO42-![]() Cr2O72-��H2O����ˣ�B�к���Ԫ�ص�������CrO42-��Cr2O72-��
Cr2O72-��H2O����ˣ�B�к���Ԫ�ص�������CrO42-��Cr2O72-��
(2)��Һ��pH��5����c(OH��)��10��9 mol��L��1��c(Cr3��)��![]() mol��L��1��6.3��10��4 mol��L��1��������Ũ��Ϊ6.3��10��4 mol��L��1��52��103 mg��mol��1��32.76 mg��L��1��1.5mg��L��1����ˣ���Һ�в����ϸ����ŷű���
mol��L��1��6.3��10��4 mol��L��1��������Ũ��Ϊ6.3��10��4 mol��L��1��52��103 mg��mol��1��32.76 mg��L��1��1.5mg��L��1����ˣ���Һ�в����ϸ����ŷű���
(3)������FeSO4��7H2O����ԭ�������������ӽ�������Ϊ�����ӣ���C�е���������Fe2����Fe3����Cr3����H��������Ksp[Fe(OH)2]�ϴ�����вμӷ�Ӧ��������һ����Fe3����Cr3����H����
������˵������ȷ����Ϊc(H��)��С����ѧƽ��2H����2CrO42-![]() Cr2O72-��H2O���淴Ӧ�����ƶ�����Һ��Cr(��)��Ҫ��CrO42-��ʽ���ڡ�
Cr2O72-��H2O���淴Ӧ�����ƶ�����Һ��Cr(��)��Ҫ��CrO42-��ʽ���ڡ�
������м����ԭ��ʱ��Ϊʹ���ò�Ʒ�к���Ԫ�����ʵĺ��������ܵͣ�����Ksp[Cr(OH)3]��6.3��10��31��Ksp[Fe(OH)2]��4.9��10��17��֪����Ҫ���Ƶ������У���м���������ҽ���Һ��pH������ʹCr3����ȫ������Fe2���������ķ�Χ�ڡ�

 Сѧѧϰ�ð���ϵ�д�
Сѧѧϰ�ð���ϵ�д� Сѧͬ�����������ܾ�ϵ�д�
Сѧͬ�����������ܾ�ϵ�д�