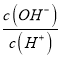��Ŀ����
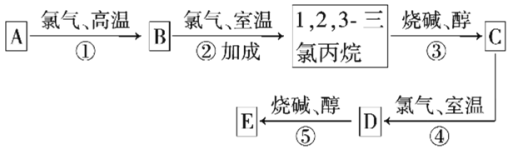
����Ŀ��������ԭ���������ε����� A��B��C��D��E��F ����Ԫ�أ���֪B ԭ��������������A ԭ�Ӵ����������� 3 ������ D ԭ�������������� 2 ����C ԭ���ڲ�������������������� 10 ����A��B��D ����Ԫ�ص�ԭ������������֮��Ϊ 13�� A ��B ԭ������������֮����D �� F ԭ������������֮����ȣ� E �� F ������Ԫ�ء��ش��������⣺
��1��E Ԫ�ص�����Ϊ__������Ԫ�����ڱ��е�λ����__��
��2��AB2 �ĵ���ʽΪ__���õ���ʽ��ʾE ���⻯����γɹ���__��
��3��C �� F Ԫ�ص�����������ˮ���ﷴӦ�Ļ�ѧ����ʽΪ__��
��4��B��C��D��F ����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����__����Ԫ�ط��ţ������Ӱ뾶��С����__�������ӷ��ţ���
��5��B �� E �ļ��⻯���зе�ϸߵ���__���ѧʽ����A ��B �ļ��⻯�����ȶ��ԽϺõ���__���ѧʽ����
��6��������Ԫ��M �� D Ԫ��λ�ڲ�ͬ���壬���ݶԽ��߹������ijЩ�������ơ��� M ��������������� C ������������Ӧ��ˮ������Һ�У�������Ӧ�����ӷ���ʽΪ__��
��7���� B��C ����Ԫ����ɵĻ����������֣�����һ��Ϊ����ɫ�������ʵĵ���ʽΪ__��
���𰸡��� �������ڵ���A�� ![]()
![]() 2Na+2HClO4===H2��+2NaClO4 Na > Al > Cl > O Al3+ H2O H2O BeO+2OH-===BeO22-+H2O
2Na+2HClO4===H2��+2NaClO4 Na > Al > Cl > O Al3+ H2O H2O BeO+2OH-===BeO22-+H2O ![]()
��������
��֪Bԭ��������������Aԭ�Ӵ�����������3������Dԭ��������������2����˵��BԪ������������Ϊ6��Dԭ������������Ϊ3��A�Ĵ���������Ϊ2��Cԭ���ڲ��������������������10������CΪNa��A��B��D����Ԫ�ص�ԭ������������֮��Ϊ13����A�������Ϊ13-6-3=4������A�ĺ��������Ϊ2+4=6ΪCԪ�أ�A��Bԭ��������������D��Fԭ������������֮�������F�������Ϊ7��F��ԭ���������ӦΪClԪ�أ�E��F����������Ԫ�أ�EΪSԪ�أ�Dԭ������������Ϊ3������DΪAlԪ�أ�BԪ������������Ϊ6����ԭ��������NaС����ΪOԪ�����Ͽ���֪����AΪCԪ�أ�BΪOԪ�أ�CΪNaԪ�أ�DΪAlԪ�أ�EΪSԪ�أ�FΪClԪ�ء�
(1)��������������EΪSԪ�أ�Ԫ������Ϊ����Ԫ�����ڱ��е�λ��Ϊ�������ڵ���A�壬�ʴ�Ϊ���������ڵ���A�壻
(2)AB2ΪCO2��Ϊ���ۻ����C��ÿ��O���γ�2�Թ��õ��Ӷԣ�����ʽΪ��![]() ��E���⻯��ΪH2S��Ϊ���ۻ����S��H�γɹ��ۼ������γɹ��̿ɱ�ʾΪ��
��E���⻯��ΪH2S��Ϊ���ۻ����S��H�γɹ��ۼ������γɹ��̿ɱ�ʾΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��![]() ��
��
(3)CΪ�ƣ���F������������Ӧ��ˮ����HClO4�����û���Ӧ������������Ӧ����ʽΪ��2Na+2HClO4===H2��+2NaClO4��
(4)�Ƚ����뾶��С���ȿ����Ӳ��������Ӳ���Խ�࣬�뾶Խ�����Ӳ�����ͬʱ�����˵������ԭ�����������˵����Խ�뾶ԽС��B��C��D��F�ֱ�ΪO��Na��Al��Cl��Oλ�ڵڶ����ڣ����Ӳ���Ϊ2�㣬Na��Al��Clλ�ڵ������ڣ����Ӳ���Ϊ3�㣬��Oԭ�Ӱ뾶��С����ԭ������Na< Al < Cl,��ԭ�Ӱ뾶��Na > Al > Cl > O��O2-��Na+��Al3+����2�����Ӳ㣬Cl-��3�����Ӳ㣬��ԭ������Al > Na > O�������Ӱ뾶��Cl- > O2- > Na+ > Al3+�������Ӱ뾶��С��ΪAl3+���ʴ�Ϊ��Na > Al > Cl > O��Al3+��
(5)B��E�γɵļ��⻯��ΪH2O��H2S����ΪH2O���Ӽ�������������H2O�ķе���ߣ�A�ļ��⻯��ΪCH4���ǽ�����O>C�����ȶ���H2O> CH4���ʴ�Ϊ��H2O��H2O��
(6) M��DԪ��λ�ڲ�ͬ���壬���ݶԽ��߹������ijЩ�������ƣ���MΪBeԪ�أ�Be�����������ΪBeO����C ������������Ӧ��ˮ����NaOH��Ӧ����Na2BeO2��H2O�����ӷ�Ӧ����ʽΪ��BeO+2OH-===BeO22-+H2O���ʴ�Ϊ��BeO+2OH-===BeO22-+H2O��
(7)Na��O��ɵĵ���ɫ������ΪNa2O2��Ϊ���ӻ�����������γɹ��õ��Ӷԣ���д����ʽʱ����������ֱ��д���ӷ��ţ���Na2O2�ĵ���ʽΪ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��

����Ŀ�����и�������������ܴﵽԤ��ʵ��Ŀ�ĵ���
ѡ�� | ���������� | ʵ��Ŀ�� |
A | �����������Թ��У��������û | ��֤����������ʴ |
B | ��NaBr��Һ�е���������ˮ�ͱ��������ã���Һ�ϲ�ʳȺ�ɫ | ֤��Br����ԭ��ǿ��Cl�� |
C | ���Ȼ���������������������ˮ�� | ����FeCl2��Һ |
D | �������Ȼ������ʵ�����ͨ��װ�б���NaHCO3��Һ��ϴ��ƿ | ��ȥ�����е�HCl���� |
A. A B. B C. C D. D
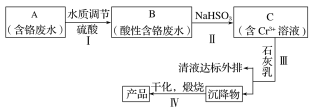
����Ŀ��ij���γ�������Cr(��)��ˮ����ȡCr2O3��һ�ֹ���������ͼ��ʾ��
��֪��Ksp[Cr(OH)3]��6.3��10��31
Ksp[Fe(OH)3]��2.6��10��39
Ksp[Fe(OH)2]��4.9��10��17
��1��������У������ķ�ӦΪ2H����2CrO42-![]() Cr2O72-��H2O��B�к���Ԫ�ص�������___(�����ӷ���)��
Cr2O72-��H2O��B�к���Ԫ�ص�������___(�����ӷ���)��
��2������Һ��Cr3����Ũ�ȡ�1.5mg��L��1ʱ������Ϊ�Ѵ�����ŷű����������Һ��pH��5������Һ�в����ϸ����ŷű�����Ϊ��ʱCr3����Ũ�ȣ�__mg��L��1��
��3����������������ʴ���NaHSO3����ԭ����
������FeSO4��7H2O����ԭ����������вμӷ�Ӧ��������һ����__(�����ӷ���)��
��������м����ԭ����������Ͷ������ͬʱ�������㣬C��Һ��pH��c(Cr2O72-)�Ķ�Ӧ��ϵ���±���ʾ��
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol��L��1 | 7.02��10��21 | 7.02��10��7 | 1.25��10��3 | 2.21��10��34 |
������ΪpH��6ʱ��c(Cr2O72-)��С��ԭ����Cr2O72-�����϶���ת��ΪCr3��������˵���Ƿ���ȷ��Ϊʲô��___��
������м����ԭ��ʱ��Ϊʹ���ò�Ʒ�к���Ԫ�����ʵĺ��������ܵͣ���Ҫ���Ƶ�������___��