题目内容
18.下列物质沸点递变顺序正确的是( )| A. | SnH4>GeH4>SiH4>CH4 | B. | SbH3>AsH3>PH3>NH3 | ||
| C. | HI>HBr>HCl>HF | D. | H2Te>H2Se>H2S>H2O |
分析 氢化物的相对分子质量越大,沸点越高,HF、H2O和NH3中有氢键的沸点较高,综合分析解答.
解答 解:A.氢化物的相对分子质量越大,沸点越高,则沸点SnH4>GeH4>SiH4>CH4 ,故A正确;
B.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,氨气分子间存在氢键,所以沸点:NH3>SbH3>AsH3>PH3,故B错误;
C.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,HF分子间存在氢键,所以沸点:HF>HI>HBr>HCl,故C错误;
D.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,水分子间存在氢键,所以沸点:H2O>H2Te>H2Se>H2S,故D错误;
故选A.
点评 本题考查了分子间作用力的大小的影响因素,注意把握氢键与物质熔沸点的关系,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
8.大气污染再次成为今年“两会”的热门议题.下列做法不能改善大气环境的是( )
| A. | 大力开发新能源和可再生能源 | |
| B. | 城市大力发展轨道交通,少开私家车 | |
| C. | 清洁燃煤、提高燃油质量 | |
| D. | 学校、家庭安装空气净化装置 |
9.下列说法正确的是( )
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 可以用NaOH溶液除去乙酸乙酯中的乙醇 | |
| C. | 天然油脂的主要成分是高级脂肪酸 | |
| D. | CH≡CH和CH2=CHCH=CH2互为同系物 |
13.下列解释事实的方程式正确的是( )
| A. | 向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl+I-=AgI+Cl- | |
| B. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 向A1C13溶液中加入过量的氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向Ca(ClO)2溶液中通入适量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
3.下列有关图示分析正确的是( )
| A. |  如图所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 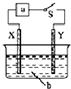 如图所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | 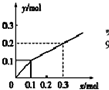 Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图,离子氧化能力M+>N3+>H+ | |
| D. | 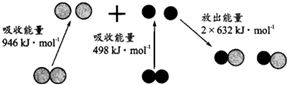 如图为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)═2NO(g)△H=-180 kJ/mol |
7.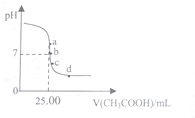 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
 室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )
室温下,向25.00mL0.1000mol•L-1的NaOH溶液中逐滴滴入0.1000mol•L-1CH3COOH溶液,PH曲线变化如图所示,则下列说法一定正确的是( )| A. | a点:c(CH3COONa)=0.1000 mol•L-1 | B. | b点:c(CH3COONa)=c(CH3COOH) | ||
| C. | c点:c(H+)=c(CH3COO-)+c(CH3COOH) | D. | d点:c(Na+)<c(CH3COO-)+c(CH3COOH) |
14.下列有关除杂质(括号中为杂质)的操作中,错误的是( )
| A. | 乙醇(甲酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物 | |
| B. | 溴乙烷(乙醇):多次加水振荡,分液,弃水层 | |
| C. | 苯(苯酚):加溴水,振荡,过滤除去沉淀 | |
| D. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层 |