题目内容
6.煤可以通过气化和液化转变为清洁能源并提高燃烧效率.煤气化的主要反应是:C(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g)气化得到的CO和H2可以进一步液化合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g)△H
(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(△H)分别为a、b、c,则上述反应的△H=a+2b-c.
(2)
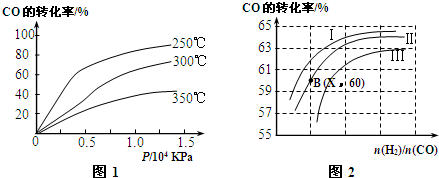
图1表示CO的转化率与温度、压强之间的关系,图2表示CO的转化率与起始投料比$\frac{n({H}_{2})}{n(CO)}$、温度的变化关系,曲线I、Ⅱ、Ⅲ对应的温度分别为T1、T2、T3,则T1、T2、T3的大小关系为T1<T2<T3,理由由图1知,在一定压强下,温度升高,CO转化率降低,正反应放热;由图2知,在投料比一定时,曲线Ⅰ、Ⅱ、Ⅲ对应的转化率依次降低,因此温度依次升高.测得B(X,60)点氢气的转化率为40%,则X=3.
(3)一定条件下,将2mol CO和4mol H2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2mol,则此时CH3OH(g)的物质的量浓度为0.5 mol/L,平衡常数K=1.下列说法中能说明反应已达到平衡状态的是A(填选项前的字母).
A.混合气体的平均摩尔质量不变
B.一氧化碳的消耗速率等于甲醇的生成速率
C.CO和H2的物质的量之比保持不变
D.混合气体的密度不变.
分析 (1)根据盖斯定律进行计算,由①+②×2-③得出正确结论;
(2)分析图象1变化可知:在一定压强下,温度越高,一氧化碳转化率越小,升温平衡逆向进行,正反应为放热反应;
分析图象2变化可知:在投料比一定时,曲线Ⅰ、Ⅱ、Ⅲ对应的转化率依次降低,因此温度依次升高;
设起始量氢气为x,一氧化碳物质的量为y,依据转化率,结合方程式进行计算;
(3)依据平衡三段式列式计算平衡浓度,再根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断,得出正确结论.
解答 解:(1)若相同温度下CO、H2、CH3OH(g)的燃烧热(△H)分别为a、b、c,则
一氧化碳燃烧的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g)△H=a
氢气燃烧的热化学方程式为:②H2(g)+1/2O2(g)=H2O(l)△H=b
甲醇燃烧的热化学方程式为:③CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l)△H=c
由①+②×2-③得,CO(g)+2H2(g)?CH3OH(g)△H=a+2b-c,
故答案为:a+2b-c;
(2)分析图象1变化可知:在一定压强下,温度越高,一氧化碳转化率越小,升温平衡逆向进行,正反应为放热反应;
分析图象2变化可知:在投料比一定时,曲线Ⅰ、Ⅱ、Ⅲ对应的转化率依次降低,因此温度依次升高;故T1<T2<T3,
设起始量氢气为x,一氧化碳物质的量为y;
CO(g)+2H2(g)?CH3OH(g)
y x 0
0.6y 0.4x
则0.6y:0.4x=1:2
x:y=3,故X=3,
故答案为:T1<T2<T3;由图1知,在一定压强下,温度升高,CO转化率降低,正反应放热;由图2知,在投料比一定时,曲线Ⅰ、Ⅱ、Ⅲ对应的转化率依次降低,因此温度依次升高;3;
(3)一定条件下,将2mol CO和4mol H2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时H2的物质的量为2mol,
则 CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) $\frac{2}{2}$ $\frac{4}{2}$ 0
变化量(mol/L) 0.5 1 0.5
平衡量(mol/L) 0.5 $\frac{2}{2}$ 0.5
故CH3OH(g)的物质的量浓度为0.5 mol/L;
平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)•{c}^{2}({H}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1;
A.平均摩尔质量=$\frac{总质量}{总物质的量}$,总质量不变,总物质的量会变,故混合气体的平均摩尔质量不变说明达到平衡状态,故A正确;
B.一氧化碳的消耗速率是正反应速率,甲醇的生成速率乙是正反应速率,故不能说明达到平衡状态,故B错误;
C.CO和H2的物质的量之比始终为1:2,故两者物质的量之比保持不变不能说明达到平衡状态,故C错误;
D.密度=$\frac{总质量}{体积}$,总质量不变,体积不变,故混合气体的密度不变不能说明达到平衡状态,故D错误;
故能说明反应已达到平衡状态的是A;
故答案为:0.5 mol/L;1;A.
点评 本题考查盖斯定律的计算应用,化学平衡图象分析、平衡常数的计算及化学平衡的影响因素,难度较大.

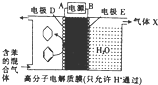 一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )
一定条件下,利用如图所示装置可实现有机物的储氢,下列有关说法正确的是( )| A. | A为电源的正极 | |
| B. | 气体X为H2 | |
| C. | 电极E为阴极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-=C6H12 |
| A. | 已知A-+H2B(过量)=HA+HB-,则结合H+的能力:HB-<A-<B2- | |
| B. | 在25℃时,将cmol/L的醋酸溶液与0.02mol/LNaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) | |
| C. | 若将CO2 通入0.1 mol/LNaOH溶液中至溶液中性,则溶液中2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol/L | |
| D. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
| A. | 元素X与氢形成的原子比为1:1的化合物有很多种 | |
| B. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| C. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
| A. | SnH4>GeH4>SiH4>CH4 | B. | SbH3>AsH3>PH3>NH3 | ||
| C. | HI>HBr>HCl>HF | D. | H2Te>H2Se>H2S>H2O |
| A. | 用无色试剂瓶盛放浓硝酸 | B. | 用铁质容器盛放浓硫酸 | ||
| C. | 用玻璃试剂瓶盛放氢氟酸 | D. | 用带橡胶塞的试剂瓶盛放苯 |
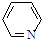 ),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
),其分子中相邻的C和N原子相比,N原子吸引电子能力更强(填“强”或“弱”),从原子结构角度解释原因:C和N原子在同一周期(或电子层数相同),N原子核电荷数更大,原子半径更小,原子核对外层电子的吸引力更强.
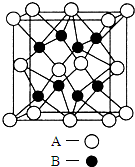 A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素.A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题: 液pH=4
液pH=4