题目内容
13.储氢纳米碳管的研制成功体现了科技的进步.用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、Cr2(SO4)3、H2O七种物质.(1)若将碳纳米颗粒分散到一定溶剂中,形成稳定的分散系,所具的性质有①②
①丁达尔效应 ②加入饱和(NH4)2SO4溶液产生聚沉 ③可通过半透膜
(2)请用上述物质填空,并配平化学方程式:
3C+2K2Cr2O7+8H2SO4→2K2SO4+3CO2+2Cr2(SO4)3+8H2O
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(5)若将一定量的上述气体通入含0.1molNaOH的溶液中,小心加热蒸干,可得7.16g固体,则在加热前溶液中离子浓度的大小关系是C(Na+)>C(HCO-3)>C(CO2-3)>C(OH-)>C(H+).
分析 (1)分散质粒度介于1-100nm的分散系属于胶体,胶体具有丁达尔效应、聚沉的性质,不能通过半透膜;
(2)根据反应中元素的化合价的变化结合原子守恒和电子守恒书写方程式;
(3)依据硫酸在反应中硫元素化合价变化及生成产物判断;
(4)根据电子转移的数目与氧化剂或还原剂之间的物质的量的关系进行计算;
(5)运用极限法假设蒸干前溶质全为氢氧化钠时物质的量为0.1mol,质量为4g;假如全都是碳酸钠,则物质的量为0.5mol,质量为5.3g,假如全都是碳酸氢钠时,物质的量为0.1mol,质量为8.4g,而实际质量为7.16g,所以为碳酸钠与碳酸氢钠的混合物,依据二氧化碳与氢氧化钠反应得到产物关系结合原子个数守恒计算碳酸钠与碳酸氢钠的物质的量,据此解答.
解答 解:(1)碳纳米颗粒大小介于1-100nm,所以分散到一定溶剂中,形成稳定的分散系属于胶体,胶体具有丁达尔效应、聚沉的性质,不能通过半透膜;
故答案为:①②;
(2)反应中C被氧化生成CO2、K2Cr2O7被还原为Cr2(SO4)3依据反应过程中得失电子守恒和原子个数守恒可配平方程式得:
3C+2K2Cr2O7+8H2SO4═3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3;2K2Cr2O7;8;2;3CO2;2;8;
(3)H2SO4在上述反应中所含元素化合价不变,与金属阳离子结合生成盐,表现出酸性,
故选:C;
(4)依据方程式可知每生成3mol二氧化碳气体,反应转移电子的物质的量为12mol,所以若反应中电子转移了0.8mol,则生成二氧化碳气体的物质的量为0.2mol,标况下体积为:0.2mol×22.4L/mol=4.48L,故答案为:4.48L.
(5)假设蒸干前溶质全为氢氧化钠时物质的量为0.1mol,质量为4g;假如全都是碳酸钠,则物质的量为0.5mol,质量为5.3g,假如全都是碳酸氢钠时,物质的量为0.1mol,质量为8.4g,而实际质量为7.16g,所以为碳酸钠与碳酸氢钠的混合物,设碳酸氢钠的物质的量为x,碳酸钠的量为y,蒸干碳酸氢钠与碳酸钠的混合物最终得到产物为碳酸钠,则依据钠原子个数守恒可得:
x+2y=0.1;依据质量守恒可得:x+y=$\frac{7.16g}{106g/mol}$;
解得:x=0.036mol,y=0.032mol,
碳酸钠为强电解质,完全电离产生碳酸根离子和钠离子;部分碳酸根离子水解生成碳酸氢根离子和氢氧根离子;
碳酸氢钠为强电解质,完全电离产生碳酸氢根离子和钠离子,碳酸氢根离子部分水解生成碳酸和氢氧根离子,
所以溶液中离子浓度大小顺序为:C(Na+)>C(HCO-3)>C(CO2-3)>C(OH-)>C(H+);
故答案为:C(Na+)>C(HCO-3)>C(CO2-3)>C(OH-)>C(H+).
点评 本题考查了胶体的性质、氧化还原方程式的书写、离子浓度大小的比较,熟悉氧化还原反应得失电子守恒规律是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 0.1mol冰醋酸、0.1mol无水乙醇和浓硫酸混合加热后可得0.1NA个乙酸乙酯分子 | |
| B. | 0.1molL-1Na2SO4溶液中含2NA个Na+ | |
| C. | 2.7g的铝是足量的NaOH溶液充分反应,转移的电子数为0.3NA | |
| D. | 标准状况下,11.2升CCl4中所含的氯原子数目为2NA |
| A. | 0.008889 | B. | 0.08000 | C. | 0.1200 | D. | 0.2400 |
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
| A. | 葡萄糖、麦芽糖均能与新制Cu(OH)2反应 | |
| B. | 富含蛋白质的豆浆煮沸后即可得人体所需的氨基酸 | |
| C. | 当人误食重金属盐时,可喝大量的牛奶、蛋清解毒 | |
| D. | 油脂在氢氧化钾溶液中水解可制得汽车洗涤用的液体肥皂 |
| A. | 煤的气化、液化是使煤变成清洁能源,减少环境污染的有效途径 | |
| B. | 高纯硅可制作太阳能电池,二氧化硅可制作光导纤维 | |
| C. | 利用工业生产产生的二氧化碳制造全降解塑料,可以缓解温室效应 | |
| D. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 向氯化铝溶液中滴加过量氨水 | 有白色沉淀产生 | Al3++3OH-=Al(OH)3↓ |
| B | 向FeBr2溶液中通入少量氯气 | 溶液由浅绿色变成黄色 | 2Fe2++Cl2=2Fe3++2Cl- |
| C | 向稀硝酸中加入单质Fe粉 | 有气泡生成 | Fe+6H+=3Fe3++3H2↑ |
| D | 向Na2CO3溶液中滴加酚酞试剂 | 溶液由无色变为红色 | CO32-+H2O=H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |


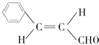 .
. .
. .
.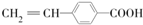 .
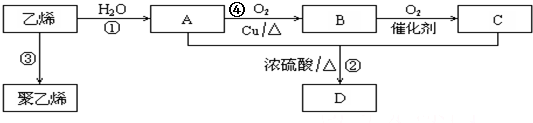
.
 ;
;