题目内容
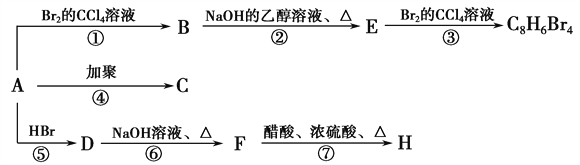
【题目】现有A、B、C、D、E、F六种装置,如图所示。(胶塞、导管可自由选用)。已知:实验室可用下列反应制取氧气2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
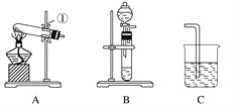
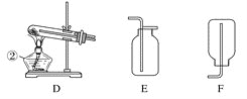
(1)写出仪器名称:①________,②________。
(2)实验室制取并收集氧气时,应选择____________和________相连接。
(3)做木炭还原氧化铜并检验生成气体的实验时,应选择________和________相连接,检验生成气体时使用的试剂是________,检验气体时观察到的实验现象是_________________。
(4)制取氢气并做还原氧化铜的实验时,应选择______和________装置,实验结束时应先停止加热,待试管冷却后,再停止通氢气,其原因是_______________________________。
【答案】铁架台 酒精灯 A E A C 澄清石灰水 C中溶液变浑浊 B D 防止生成的铜再和氧气反应
【解析】
(1)根据仪器的图形、构造判断仪器的名称;
(2)实验室可用加热氯酸钾固体制备氧气,根据氧气密度大于空气分析;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,用澄清石灰水检验;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止铜被氧化。
(1)由仪器的图形、构造判断①为铁架台,②为酒精灯;
(2)实验室可用加热氯酸钾固体制备氧气,氧气密度比空气大,可用向上排空法收集,则选用A、E装置;
(3)做木炭还原氧化铜并检验生成气体的实验,可在大试管中加热条件下进行,氧化产物是二氧化碳,因此可用澄清石灰水检验,所以用A、C装置,检验气体时观察到的实验现象是C中澄清石灰水变浑浊;
(4)用稀硫酸和锌反应制备氢气,在大试管中加热条件下进行还原实验,可用B、D装置,在加热的条件下铜易被氧化,所以实验结束时应先停止加热,待试管冷却后,再停止通氢气,防止生成的铜再和氧气反应。

 名校课堂系列答案
名校课堂系列答案【题目】下表是常温下,浓度为0.01mol/L的NaOH溶液与几种酸或盐混合后的情况:
混合组别 | 混合前酸或盐的总浓度 | 混合比例及混合溶液性质 |
① | c(HA)=0.02mol/L | 等体积混合,pH>7 |
② | HB溶液的pH=2 | V1mLNaOH溶液与V2mLHB溶液,pH=7 |
③ | c(H2C)=0.01mol/L | 等体积混合,pH>7 |
④ | c(NaHD)=0.01mol/L | 等体积混合,pH=7 |
回答下列问题:
(1)①组混合液中,HA、A-、Na+三种粒子浓度由大到小的顺序为________,若pH=8,则c(Na+)-c(A-)=________mol/L(填具体数字)。
(2)由②组混合液pH=7可推知,V1____V2。
(3)③组混合液中,pH>7的原因是______________________。
(4)0.01mol/LNaHD溶液中,水的电离度=_________。(已知:水的电离度=[已电离的水分子的个数/水分子总数]×100%)
(5)仅凭上述结果,一定能确定HA、HB、H2C、H2D四种酸中属于弱酸的是_________。