题目内容
【题目】高氯酸铜易溶于水,在130℃时会发生分解反应,是一种燃烧催化剂。以食盐等为原料制备高氯酸铜[Cu(ClO4)2·6H2O]的一种工艺流程如下:

(1)发生“电解I”时,所用的交换膜是_______________(填“阳离子交换膜”或“阴离子交换膜”)。
(2)歧化反应是同一种物质中同种元素自身的氧化还原反应,已知上述工艺流程中“歧化反应”的产物之一为NaClO3。
①“歧化反应”的化学方程式为____________________________。
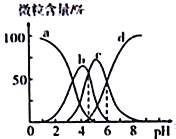
②“歧化反应”阶段所采用的不同温度对产率影响的结果如图所示。则该反应最适宜的温度是___。

(3)“电解II”的阳极产物为______________(填离子符号)。
(4)操作a的操作名称是_______,该流程中可循环利用的物质是_____________(填化学式)。
(5)用该工艺流程制备高氯酸铜时,若起始时NaCl的质量为at,最终制得的Cu(ClO4)2·6H2O为bt,则产率为__________(用含a、b的代数式表示)。
【答案】 阳离子交换膜 3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2 60℃ ClO4- 蒸发浓缩 NaCl (702b/371a)×100%
5NaCl+NaC1O3+3CO2 60℃ ClO4- 蒸发浓缩 NaCl (702b/371a)×100%
【解析】以食盐等为原料制备高氯酸铜[Cu(C1O4)26H2O],则生成产物应生成高氯酸钠,电解氯化钠溶液生成氢氧化钠、氢气和氯气,“歧化反应”时,高氯酸钠与碳酸钠溶液发生歧化反应,生成的产物之一为NaClO3 ,同时生成二氧化碳气体,通电电解,溶液其中氯酸根离子失电子发生氧化反应生成高氯酸根离子,加入盐酸,过滤除去氯化钠晶体,得到60%以上的高氯酸,“反应II”阶段,Cu2(OH)2CO3与HClO4反应经过一系列操作后得到蓝色Cu(ClO4)2溶液。
(1)“电解I”所发生的反应是电解氯化钠溶液生成氢氧化钠、氢气和氯气,反应的离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,需要防止氢氧根离子与氯气反应,因此选择阳离子交换膜,故答案为:阳离子交换膜;
2OH-+H2↑+Cl2↑,需要防止氢氧根离子与氯气反应,因此选择阳离子交换膜,故答案为:阳离子交换膜;
(2)①“歧化反应”时,氯气通入碳酸钠溶液发生反应,生成的产物之一为NaClO3同时生成二氧化碳气体,歧化反应的化学方程式为3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2,故答案为:3Na2CO3+3Cl2
5NaCl+NaC1O3+3CO2,故答案为:3Na2CO3+3Cl2![]() 5NaCl+NaC1O3+3CO2;
5NaCl+NaC1O3+3CO2;
②图象分析可知60°C产率最高,则该反应最适宜的温度是:60°C,故答案为:60℃;
(3) 通电电解,溶液其中氯酸根离子失电子发生氧化反应在阳极生成高氯酸根离子,“电解II”的阳极产物为ClO4-,故答案为:ClO4-;
(4) 加入盐酸,过滤除去氯化钠晶体,通过蒸发浓缩即可得到60%以上的高氯酸;该流程中可循环利用的物质是NaCl,故答案为:蒸发浓缩;NaCl;
(5)根据流程图,氯化钠电解生成的氯气与碳酸钠反应生成NaC1O3和NaCl,电解后NaC1O3变成NaC1O4,加入盐酸反应生成HC1O4,最后与Cu2(OH)2CO3反应生成Cu(ClO4)2·6H2O
假设起始是氯化钠为6mol,则生成的氯气为3mol,得到1molNaC1O3,根据氯元素守恒最终得到0.5molCu(ClO4)2·6H2O,因此产率=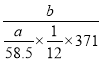 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为: ![]() ×100%。
×100%。