题目内容
2.下列递变规律正确的是( )| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |
分析 A、据元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强;
B、根据同一周期,从左至右,元素的金属性逐渐减弱;
C、电子层数越多半径越大,半径相同时核电荷数越多半径越小;
D、根据元素的非金属性越强其对应的氢化物越稳定;
解答 解:A、因元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强,金属性:K>Ca>Mg>Al,所以碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3,故A错误;
B、因同一周期,从左至右,元素的金属性逐渐减弱,则金属性:Na>Mg>Al>Si,故B错误;
C、电子层数越多半径越大,半径相同时核电荷数越多半径越小,K是四个电子层,S、Na三个电子层,O是两个电子层,所以O、S、Na、K的原子半径依次增大,故C正确;
D、因元素的非金属性越强其对应的氢化物越稳定,非金属性:F>Cl>S>P,所以稳定性:HF>HCl>H2S>PH3,故D错误;
故选C.
点评 本题主要考查了元素周期律的应用,难度不大,学生要注意氢化物的稳定性与元素的非金属性有关.

练习册系列答案
 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
12.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,下列操作会造成测定结果偏高的原因是( )
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
13.下列叙述错误的是( )
| A. | 用金属钠可区分乙醇和乙醚 | |
| B. | 用高锰酸钾酸性溶液可区分乙烷和乙烯 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用裂化汽油从碘水中提取碘 |
7.针对如表9种元素,完成以下各小题
(1)单质为有色气体的元素是氯(填名称).
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为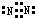 .
.
(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为
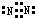 .
.(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
11.下列说法正确的是( )
| A. | 常温下,淀粉遇I-变蓝色 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 纤维素属于高分子化合物,与淀粉互为同分异构体 | |
| D. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 |
12.氢-氧燃料电池是将H2和O2分别通入电池,穿过浸入20%~40%的KOH溶液的多孔碳电极,其电极反应式为:H2+2OH--2e-═2H2O和 O2+2H2O+4e-═4OH-.则下列叙述正确的是( )
| A. | 通H2的一极是正极 | |
| B. | 通O2的一端极是负极 | |
| C. | 工作一段时间后电解质溶液pH增大 | |
| D. | 工作一段时间后电解质溶液pH减小 |
 ;
;
 乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到饱和碳酸钠溶液的液面上.
乙酸和乙醇反应的装置如图所示:在试管里加入3mL乙醇,然后一边摇动,一边慢慢地加入2mL浓硫酸和2mL冰醋酸,用酒精灯小心均匀地加热10min,将产生的蒸气经长导管通入到饱和碳酸钠溶液的液面上.