题目内容
7.针对如表9种元素,完成以下各小题| 周期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)③与④⑤简单离子的半径由大到小的顺序为O2->Na+>Mg2+(填离子符号).
(3)元素②的单质的电子式为
 .
.(4)最高价氧化物对应的水化物酸性最强的是HClO4.(填化学式)
(5)④和⑥的最高价氧化物对应的水化物反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(6)⑦的单质的用途正确的是BD.
A.光导纤维 B.太阳能电池 C.普通玻璃 D.计算机芯片
(7)元素①和⑦非金属性较强的是C,写出一个能表示二者非金属性强弱关系的化学方程式为:Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
分析 由元素在周期表的位置可知,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)只有氯气为黄绿色气体单质;
(2)③与④⑤简单离子具有相同电子排布,原子序数大的离子半径小;
(3)元素②的单质为氮气;
(4)Cl的最高价氧化物对应的水化物酸性最强;
(5)④和⑥的最高价氧化物对应的水化物反应生成偏铝酸钠和水;
(6)⑦的单质具有金属性和非金属性;
(7)非金属性C>Si,由强酸制取弱酸的原理及最高价氧化物的水化物酸性比较非金属性.
解答 解:由元素在周期表的位置可知,①为C,②为N,③为O,④为Na,⑤为Mg,⑥为Al,⑦为Si,⑧为S,⑨为Cl,
(1)只有氯气为黄绿色气体单质,则单质为有色气体的元素是Cl(氯),故答案为:氯;
(2)③与④⑤简单离子具有相同电子排布,原子序数大的离子半径小,则离子半径为O2->Na+>Mg2+,故答案为:O2->Na+>Mg2+;
(3)元素②的单质为氮气,其电子式为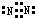 ,故答案为:
,故答案为: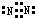 ;
;
(4)Cl的最高价氧化物对应的水化物酸性最强,则酸为HClO4,故答案为:HClO4;
(5)④和⑥的最高价氧化物对应的水化物反应生成偏铝酸钠和水,离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(6)⑦的单质具有金属性和非金属性,可作太阳能电池、计算机芯片的材料,故答案为:BD;
(7)非金属性C>Si,能表示二者非金属性强弱关系的化学方程式为Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,故答案为:C;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓.
点评 本题考查位置、结构与性质的综合应用,为高频考点,把握元素的位置、元素化合物知识为解答的关键,侧重分析、推断及应用能力的考查,题目难度不大.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 金刚石与石墨互为同位素 | |
| B. | 相同物质的量的石墨具有的能量比金刚石具有的能量高 | |
| C. | 金刚石不如石墨稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
| A. | KOH、Ca(OH)2、Mg(OH)2、Al(OH)3的碱性逐渐增强 | |
| B. | Na、Mg、Al、Si的金属性逐渐增强 | |
| C. | O、S、Na、K的原子半径依次增大 | |
| D. | HF、HCl、H2S、PH3的稳定性依次增强 |
| A. | HI | B. | NH3 | C. | SO2 | D. | H2S |
①Cu2S ②SO3 ③NH4NO3 ④FeS ⑤NH3.
| A. | 只有①②③⑤ | B. | 只有①④⑤ | C. | 只有①③④⑤ | D. | 全部 |

| A. | 一定状况下,气体摩尔体积(y)与该气体的物质的量(x)的关系 | |
| B. | 铁在氯气中燃烧,生成FeCl3的物质的量(y)与消耗氯气的物质的量(x)的关系 | |
| C. | 将铁在常温下放入浓硫酸中,生成气体的物质的量(y)与消耗浓硫酸的物质的量(x)的关系 | |
| D. | H2SO4溶液的物质的量浓度(y)与其质量分数(x) 的关系 |
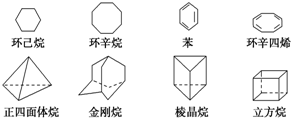 下列是八种环状的烃类物质:
下列是八种环状的烃类物质: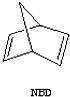 $?_{暗处}^{光照}$
$?_{暗处}^{光照}$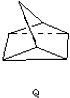 △H=+88.62kJ/mol
△H=+88.62kJ/mol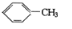 .若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.
.若用氯原子取代NBD分子中的一个H原子,可得到的同分异构体共有3种.