题目内容
10.下列分离或除杂方法不正确的是( )| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
分析 A.硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大;
B.苯与溴苯混溶,但沸点不同;
C.水与酒精不分层;
D.HCl与饱和NaHCO3溶液反应生成二氧化碳,而二氧化碳不能.
解答 解:A.硝酸钾的溶解度受温度影响大,而NaCl的溶解度受温度影响不大,则用结晶法除去硝酸钾中的氯化钠杂质,故A正确;
B.苯与溴苯混溶,但沸点不同,则用蒸馏法分离苯和溴苯,故B正确;
C.水与酒精不分层,则不能利用分液法分离,应利用蒸馏分离,故C错误;
D.HCl与饱和NaHCO3溶液反应生成二氧化碳,而二氧化碳不能,则用饱和NaHCO3溶液除去CO2中混有的少量HCl气体,故D正确;
故选C.
点评 本题考查物质分离、提纯实验方案的设计,为高频考点,把握物质的性质及混合物中性质的差异设计分离方法为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列叙述正确的是( )
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高
④难失去电子的原子,易形成阴离子
⑤单质分子中不存在化学键,化合物的分子中才存在化学键
⑥离子化合物中一定含有离子键.
①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高
④难失去电子的原子,易形成阴离子
⑤单质分子中不存在化学键,化合物的分子中才存在化学键
⑥离子化合物中一定含有离子键.
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
1.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 1mol苯中碳碳双键的个数为3 NA | |
| B. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| C. | 0.1mol/L的FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 在标准状况下,2.24 L NO和1.12 L O2混合后的原子总数为0.3 NA |
18.下列类推结论中正确的是( )
| A. | 非金属性:F>Cl,则熔点NaF>NaCl | |
| B. | 钠单质与水反应剧烈,锂单质与水反应也十分剧烈 | |
| C. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 | |
| D. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
5.(双选)在所给的有机化合物的结构简式中找出属于醚类化合物的是( )
| A. |  | B. | 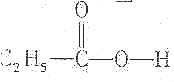 | ||
| C. | CH2═CH-O-CH2CH3 | D. | 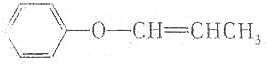 |
15. 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol•L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A. | 图中A点对应溶液的pH:a=1 | |
| B. | 生成沉淀的最大质量m=2.33g | |
| C. | 原混合液中c(HCl)=0.1mol•L-1 | |
| D. | 当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+) |
2.4p能级只填充一半电子的原子,其原子序数是( )
| A. | 15 | B. | 33 | C. | 35 | D. | 51 |
19.下列叙述不正确的是( )
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的半径依次增大 | |
| D. | H3SiO3、H2CO3、H2SO4的酸性依次增强 |
20.下列有关FeBr2溶液的叙述错误的是( )
| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO42-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |