题目内容
1.设阿伏加德罗常数的数值为NA,下列说法正确的是( )| A. | 1mol苯中碳碳双键的个数为3 NA | |
| B. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| C. | 0.1mol/L的FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 在标准状况下,2.24 L NO和1.12 L O2混合后的原子总数为0.3 NA |
分析 A、苯不是单双键交替的结构;
B、铜只能与浓硫酸反应,与稀硫酸不反应;
C、溶液体积不明确;
D、根据质量守恒判断,无论怎样反应,含有的原子数不会变化;
解答 解:A、苯不是单双键交替的结构,无双键,故A错误;
B、铜只能与浓硫酸反应,与稀硫酸不反应,故硫酸不能反应完全,则生成的SO2的分子数小于0.1NA,故B错误;
C、溶液体积不明确,故溶液中的铁离子的个数无法计算,故C错误;
D、标况下,1.12LNO与1.12LO2的混合物中各自物质的量为0.05mol,均含有0.1mol原子,根据质量守恒,反应后原子的物质的量还是0.2mol,含有的原子总数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:下列说法不正确的是( )
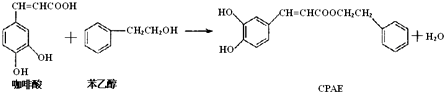

| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
9.X、Y为短周期元素,X位于第ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
16.下列化合物电子式书写正确的是( )
| A. | 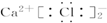 | B. | 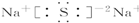 | C. | 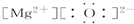 | D. | 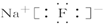 |
6.关于下列装置图的叙述中正确的是( )
| A. | 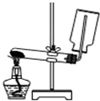 制备和收集氧气的实验装置 | |
| B. |  蒸馏海水的实验装置 | |
| C. |  导气管插入碳酸钠溶液液面下可防止乙酸乙酯挥发 | |
| D. |  制取氢氧化亚铁时能观察到白色沉淀 |
13.某有机物的结构简式为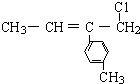 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
