题目内容
18.下列类推结论中正确的是( )| A. | 非金属性:F>Cl,则熔点NaF>NaCl | |
| B. | 钠单质与水反应剧烈,锂单质与水反应也十分剧烈 | |
| C. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 | |
| D. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
分析 A.离子半径越小,形成的离子晶体的熔点越高;
B.Li的活泼性比Na弱;
C.SiO2是由原子构成的原子晶体;
D.氢化物的相对分子质量越大,沸点越高,含有氢气的沸点较高.
解答 解:A.同主族从上到下,随着原子序数的增大,半径依次增大,原子核对外层电子的吸引能力减弱,非金属性减弱,则非金属性:F>Cl,离子半径越小,形成的离子晶体的熔点越高,所以熔点NaF>NaCl,故A正确;
B.Li的活泼性比Na弱,Li与水反应较缓慢,故B错误;
C.干冰(CO2)是由分子构成的分子晶体,SiO2是由原子构成的原子晶体,二者晶体类型不同,故C错误;
D.氢化物的相对分子质量越大,沸点越高,则ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;由于氨气分子间存在氢键,沸点较高,则ⅤA族元素氢化物沸点顺序是:NH3>AsH3>PH3,故D错误.
故选A.
点评 本题考查了晶体的构成、熔沸点的比较、氢键等,题目难度不大,注意把握同主族元素性质的变化规律.

练习册系列答案
相关题目
8.化学与社会、生活、生产密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
9.X、Y为短周期元素,X位于第ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
6.关于下列装置图的叙述中正确的是( )
| A. | 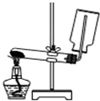 制备和收集氧气的实验装置 | |
| B. |  蒸馏海水的实验装置 | |
| C. |  导气管插入碳酸钠溶液液面下可防止乙酸乙酯挥发 | |
| D. |  制取氢氧化亚铁时能观察到白色沉淀 |
13.某有机物的结构简式为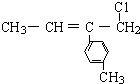 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢.以下关于PH3的叙述正确的是( )
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
8.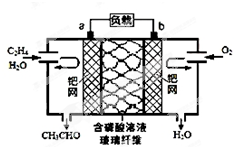 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )| A. | 该电池可以实现化学能和电能的互相转化 | |
| B. | 每有1mol 乙烯反应,则迁移2 mol H+ | |
| C. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |