题目内容
19.下列叙述不正确的是( )| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的半径依次增大 | |
| D. | H3SiO3、H2CO3、H2SO4的酸性依次增强 |
分析 A、元素的非金属性越强其对应的氢化物越稳定;
B、元素的金属性越强其对应的最高价氧化物对应的水化物的碱性越强;
C、同一周期,从左至右,阳离子的半径逐渐减小;
D、元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强.
解答 解:A、元素的非金属性越强其对应的氢化物越稳定,非金属性:F>O>S,则H2S、H2O、HF的稳定性依次增强,故A正确;
B、元素的金属性越强其对应的最高价氧化物的水化物的碱性越强,金属性:Rb>K>Ca,则RbOH、KOH、Ca(OH)2的碱性依次减弱,故B正确;
C、同一周期,从左至右,阳离子的半径逐渐减小,则Na+、Mg2+、Al3+的半径依次减小,故C错误;
D、元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Si<C<S,则H2SiO3、H2CO3、H2SO4的酸性依次增强,故D正确.
故选C.
点评 本题主要考查了元素周期律的应用,题目难度不大,注意把握同周期和同主族元素性质的递变规律.

练习册系列答案
相关题目
9.X、Y为短周期元素,X位于第ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢.以下关于PH3的叙述正确的是( )
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
4.下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是( )
| A. |  实验室制乙烯 | |
| B. | 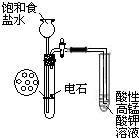 实验室制乙炔并验证乙炔发生氧化反应 | |
| C. | 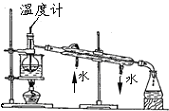 实验室中分馏石油 | |
| D. | 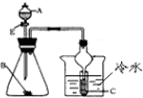 若A为稀硫酸、B为碳酸钠(粉状)、C为苯酚钠溶液,验证稀硫酸、苯酚、碳酸酸性的强弱 |
11.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈小,它的电导愈大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度.现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的 ( )
| A. | Na2SO3溶液 | B. | KI溶液 | C. | NaOH溶液 | D. | H2O |
8.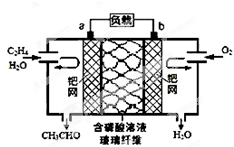 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )| A. | 该电池可以实现化学能和电能的互相转化 | |
| B. | 每有1mol 乙烯反应,则迁移2 mol H+ | |
| C. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
9.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硫酸钾溶液 | B. | 醋酸 | C. | 氯化钠(固体) | D. | 盐酸 |