题目内容
20.下列有关FeBr2溶液的叙述错误的是( )| A. | 滴加KI-淀粉溶液变为蓝色 | |
| B. | 该溶液中Cu2+、NH4+、SO42-、Cl- 可以大量共存 | |
| C. | 与硝酸酸化的AgNO3溶液反应有沉淀生成并放出气体 | |
| D. | 向该溶液中通入过量Cl2,反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
分析 A.KI与FeBr2不反应;
B.离子之间不反应,且与FeBr2不反应;
C.亚铁离子与硝酸发生氧化还原反应生成NO,溴离子与银离子反应生成AgBr;
D.通入过量Cl2,亚铁离子、溴离子均被氧化.
解答 解:A.KI与FeBr2不反应,则滴加KI-淀粉溶液无现象,故A错误;
B.离子之间不反应,且与FeBr2不反应,则离子之间可大量共存,故B正确;
C.亚铁离子与硝酸发生氧化还原反应生成NO,溴离子与银离子反应生成AgBr沉淀,则反应有沉淀生成并放出气体,故C正确;
D.通入过量Cl2,亚铁离子、溴离子均被氧化,则离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,遵循电子、电荷守恒,故D正确;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
11.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈小,它的电导愈大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度.现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的 ( )
| A. | Na2SO3溶液 | B. | KI溶液 | C. | NaOH溶液 | D. | H2O |
8.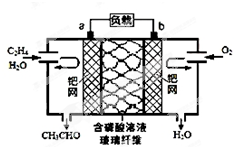 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO. 下列有关说法正确的是( )| A. | 该电池可以实现化学能和电能的互相转化 | |
| B. | 每有1mol 乙烯反应,则迁移2 mol H+ | |
| C. | 正极反应式为:O2+4e-+2H2O=4OH- | |
| D. | 电子移动方向:电极a→磷酸溶液→电极b |
15.下列对实验现象的解释与结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向某溶液中加入BaCl2溶液 | 有白色沉淀产生 | 生成了难溶于水的BaSO4,该溶液中一定含有SO42- |
| B | 向甲苯中滴入少量浓溴水,振荡,静置 | 溶液分层,上层呈橙红色,下层几乎无色 | 甲苯和溴水发生取代反应,使溴水褪色 |
| C | 向鸡蛋清溶液中,加入饱和(NH4)2SO4溶液 | 有白色沉淀产生 | 蛋白质发生了盐析 |
| D | 向蔗糖中加入浓硫酸 | 变黑,放热,体积膨胀,放出刺激性气体 | 浓硫酸具有吸水性和强氧化性,反应中生成C、SO2和CO2等 |
| A. | A | B. | B | C. | C | D. | D |
12.X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若HnY的水溶液为酸性,则HnX的酸性比HnY的酸性更强 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |
9.100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硫酸钾溶液 | B. | 醋酸 | C. | 氯化钠(固体) | D. | 盐酸 |
10.A、B、C是周期表中相邻的三种元素,A和B是同周期,B和C同主族,三种元素最外层电子总数之和为17,核内质子数之和为31,则A、B、C三种元素是( )
| A. | Mg、Al、B | B. | N、O、S | C. | Li、Be、Mg | D. | B、F、Cl |
 .
. .
. .
.