题目内容
20.下列叙述正确的是( )①两种原子构成的共价化合物分子中的化学键都是极性键
②两种不同非金属元素原子间形成的化学键都是极性键
③含有非极性键的化合物一定是共价化合物,只要是离子化合物,其熔点就比共价化合物的熔点高
④难失去电子的原子,易形成阴离子
⑤单质分子中不存在化学键,化合物的分子中才存在化学键
⑥离子化合物中一定含有离子键.
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
分析 一般金属元素与非金属元素形成离子键,非金属元素之间形成共价键,不同种非金属元素形成极性共价键,同种非金属元素形成非极性键,含离子键的化合物一定为离子化合物,共价化合物中一定不含离子键,以此来解答.
解答 解:①两种原子构成的共价化合物分子中的化学键不一定都是极性键,如H2O2中既有极性键也有非极性键,故①错误;
②两种不同非金属元素原子间形成的化学键都是极性共价键,如HCl,故②正确;
③含有非极性键的化合物不一定是共价化合物,如Na2O2,离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅的熔点大于NaCl的,故③错误;
④难失去电子的原子,不一定易形成阴离子,如稀有气体等,故④错误;
⑤单质分子中可能存在化学键,如氢气中含有H-H键,而稀有气体中没有化学键,多原子构成的分子中含有共价键,化合物的分子一定存在化学键,故⑤错误;
⑥离子化合物是阴阳离子间通过离子键形成的化合物,所以离子化合物中一定含有离子键,故⑥正确;
故选A.
点评 本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,难度不大.

练习册系列答案
相关题目
10.节能减排是中国转型发展的必经之路,工业生产中联合生产是实现节能减排的重要措施.下图是几种工业生产的联合生产工艺:

请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净
装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
符合表中的平衡常数x的数值是B(填字母序号).
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
反应从2min到4min之间,H2的平均反应速率为0.3mol•L-1•min-1.反应达到平衡时CO的转化率为62.5%.反应在第2min时改变了反应条件,改变的条件可能是A(填字母序号).
A使用催化剂 B降低温度C增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O.

请回答下列问题:
(1)装置甲为电解池(惰性电极),根据图示转化关系可知:A为Cl2(填化学式),阴极反应式为2H++2e-=H2↑.
(2)装置丙的反应物为Ti,而装置戊的生成物为Ti,这两个装置在该联合生产中并不矛盾,原因是进入装置丙的Ti含有的杂质较多,从装置戊中出来的Ti较为纯净
装置戊进行反应时需要的环境为C(填字母序号).
A.HCl气体氛围中 B.空气氛围中 C.氩气氛围中 D.水中
(3)装置乙中发生的是工业合成甲醇的反应:CO(g)+2H2(g)=CH3OH(g)△H<0.
①该反应在不同温度下的化学平衡常数(K)如下表:
| 温度/℃ | 250 | 350 |
| K | 2.041 | x |
A.0 B.0.012 C.32.081 D.100
②若装置乙为容积固定的密闭容器,不同时间段各物质的浓度如下表:
| c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 | |
| 0min | 0.8mol•L-1 | 1.6mol•L-1 | 0 |
| 2min | 0.6mol•L-1 | y | 0.2mol•L-1 |
| 4min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
| 6min | 0.3mol•L-1 | 0.6mol•L-1 | 0.5mol•L-1 |
A使用催化剂 B降低温度C增加H2的浓度
(4)装置己可以看作燃料电池,该燃料电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O.
8.化学与社会、生活、生产密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
15.在3L密闭容器中,充入1mol N2和3 mol H2并在一定条件下发生反应,20s后达到反应限度,测得混合气体总物质的量为3.4mol.下列计算结果正确的是( )
| A. | 20s后,混合气中n(H2):n(N2):n(NH3)=1:2:3 | |
| B. | N2的转化率为30% | |
| C. | 20s内H2的平均反应速率为1.5mol•L-1•s-1 | |
| D. | NH3的体积分数为25% |
12.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:下列说法不正确的是( )
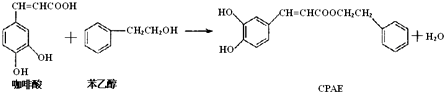

| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
9.X、Y为短周期元素,X位于第ⅠA族,X与Y可形成化合物X2Y,下列说法正确的是( )
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
