题目内容
2.4p能级只填充一半电子的原子,其原子序数是( )| A. | 15 | B. | 33 | C. | 35 | D. | 51 |
分析 根据核外电子排布规律可知,4p轨道填充一半的元素,原子核外电子排布式为1s22s22p63s23p63d104s24p3,原子序数=核外电子数以此解答该题.
解答 解:4p轨道填充一半的元素,根据核外电子排布规律可知,原子核外电子排布式为1s22s22p63s23p63d104s24p3,原子核外有33个电子,则原子序数为33,故选B.
点评 本题考查原子核外电子排布,题目难度不大,本题注意根据4p轨道填充一半判断应为3个电子,根据能量最低原理可写出电子排布式.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
12.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:下列说法不正确的是( )
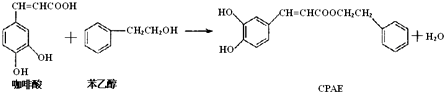

| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
13.某有机物的结构简式为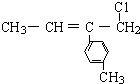 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |
10.下列分离或除杂方法不正确的是( )
| A. | 用结晶法除去硝酸钾中的氯化钠杂质 | |
| B. | 用蒸馏法分离苯和溴苯 | |
| C. | 用分液法分离水和酒精 | |
| D. | 用饱和NaHCO3溶液除去CO2中混有的少量HCl气体 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 可用酒精萃取碘水中的碘 | |
| D. | 称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
7.膦(PH3)又称磷化氢,在常温下是一种无色有大蒜臭味的有毒气体,电石气的杂质中常含有磷化氢.以下关于PH3的叙述正确的是( )
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
11.用下列方法测定空气中的污染物含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈小,它的电导愈大),如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S,但电导变化不大;若用浓溴水吸收,仅限于低浓度范围内的H2S,但有很高的灵敏度.现要兼顾吸收容量与灵敏度,测定空气中Cl2的含量,则应选用下列吸收剂中的 ( )
| A. | Na2SO3溶液 | B. | KI溶液 | C. | NaOH溶液 | D. | H2O |
12.X、Y为同主族元素,Y的原子半径大于X.下列说法正确的是(m、n均为正整数)( )
| A. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 | |
| B. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 | |
| C. | 若HnY的水溶液为酸性,则HnX的酸性比HnY的酸性更强 | |
| D. | 若Y的最高正价为+7,则X的最高正价一定为+7 |