题目内容
20.下列除杂操作正确的是( )| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀氢氧化钠溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 蔗糖 | 饱和硫酸铵溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.三溴苯酚以及溴都易溶于苯;
B.二者都可与饱和碳酸钠溶液反应;
C.二者都可与氢氧化钠溶液反应;
D.蛋白质发生盐析,蔗糖易溶于水,过滤可除杂.
解答 解:解:A、苯酚和溴水发生反应生成2,4,6-三溴苯酚和有机溶剂苯是互溶的,不能过滤分离,应加入氢氧化钠溶液除杂,故A错误;
B、饱和碳酸钠溶液可以和二氧化硫以及二氧化碳反应,应用饱和碳酸氢钠溶液除杂,故B错误;
C、氢氧化钠可以和乙酸发生中和反应,还可以和乙酸乙酯发生酯的水解反应,不符合除杂原则,应用饱和碳酸钠溶液,故C错误;
D.蛋白质发生盐析,蔗糖易溶于水,过滤可除杂,且盐析为可逆过程,蛋白质性质不变,故D正确.
故选D.
点评 本题综合考查物质的分离提纯,为高考常见题型和高频考点,侧重于化学知识的综合应用,题目难度中等,注意除杂时不能引入新的杂质.

练习册系列答案
相关题目
10.某兴趣小组对铜与浓硫酸反应产生的黑色沉淀(可能含有CuO、CuS、Cu2S,其中CuS和 Cu2S不溶于稀盐酸、稀硫酸)进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
(4)CuS固体能溶于热的浓硫酸,请用有关平衡移动原理加以解释:CuS存在溶解平衡CuS(s)?Cu2+(aq)+S2-(aq),热的浓硫酸将S2-氧化,使S2-浓度减小,促进上述平衡向正向移动,使CuS溶解.
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
Ⅰ.将光亮铜丝插人浓硫酸,加热;
Ⅱ.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用.
回答下列问题:
(1)步骤Ⅱ产生气体的化学式为SO2.
(2)向含微量 Cu2+试液中滴加K4[Fe(CN)6]溶液,能产生红褐色沉淀.现将少量黑色沉淀放入稀硫酸中,充分振荡以后,再滴加K4[Fe(CN)6]溶液,未见红褐色沉淀,由此所得结论是黑色沉淀不含CuO.
(3)为证明黑色沉淀含有铜的硫化物,进行如下实验:
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O=BaSO4↓+NO+2H+ |
(5)为测定黑色沉淀中Cu2S 的百分含量,取0.2g 步骤Ⅰ所得黑色沉淀,在酸性溶液中用 40.0mL 0.075mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+═10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+═5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,过量的高锰酸钾溶液恰好与35.0mL 0.1mol/L (NH4)2Fe(SO4)2 溶液反应完全.则混合物中Cu2S 的质量分数为40%.
11.下列叙述正确的是 ( )
| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
8.用下列装置进行实验,设计正确且能达到实验目的是( )
| A. |  制取少量H2 | |
| B. |  分离Na2CO3溶液和CH3COOC2H5的混合物 | |
| C. |  验证Na和水反应为放热效应 | |
| D. |  收集氨气 |
15.X、Y、Z、W、Q是原子充数依次增大的前四周期元素,X的基态原子s电子总数是p电子总数的2倍;Z是地壳中含量最多的元素;W、Q同周期,且最外层电子数都为1,Q的核外电子排布中未成对电子数为6.下列说法错误的是( )
| A. | X、Y、Z的气态氢化物的稳定性依次增强 | |
| B. | XZ2分子中δ键与π键个数之比为1:1 | |
| C. | 原子半径由大到小的顺序:W>Z>Y | |
| D. | 由Z、W、Q三种元素形成的某种化合物可用于检查司机是否酒后驾车 |
12.NA表示阿尔加德罗常数的值,下列说法不正确的是( )
| A. | 5.6g金属铁于足量的盐酸反应,转移电子数为0.2NA | |
| B. | 标准状况下,以任意比混合的H2、CO2的混合气体22.4L,所含分子数为NA | |
| C. | 含NA个Na+的Na2O2溶于1L水中,溶质的物质的量浓度为1mol•L-1 | |
| D. | 20g重水(D2O)所含的电子数为10NA |

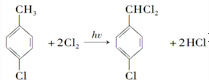 ;该反应的类型为取代反应.
;该反应的类型为取代反应. .
.