题目内容
11.下列叙述正确的是 ( )| A. | 含有金属阳离子的晶体一定是离子晶体 | |
| B. | 化合物硫氰化铁和氢氧化二氨合银中都存在配位键 | |
| C. | KCl、HF、CH3CH2OH、SO2都易溶于水,且原因相同 | |
| D. | MgO的熔点比NaCl的高,主要是因为MgO的晶格能大于NaCl的晶格能. |
分析 A.含有金属阳离子的晶体可能是金属晶体;
B.硫氰化铁是铁离子和硫氰根离子形成的配位化合物;
C.KCl、HF、CH3CH2OH、SO2都易溶于水,但原因不完全相同,二氧化硫和水反应;
D.均为离子晶体,晶格能大的熔点高,晶格能与离子半径与离子电荷有关.
解答 解:A.含有金属阳离子的晶体可能是金属晶体,如Fe、Cu等,故A错误;
B.硫氰化铁是铁离子和硫氰根离子形成的配位化合物,氢氧化二氨合银含有配位键、离子键和共价键,故B正确;
C.KCl、HF、CH3CH2OH、SO2都易溶于水,二氧化硫和水生成亚硫酸,氟化氢、乙醇和水形成氢键,氯化钠在水溶液里电离,所以其原因不同,故C错误;
D.决定晶格能的因素为:离子电荷、离子半径、离子的电子层构型,MgO所带电荷多,MgO的熔点高于NaCl,故D正确.
故选BD.
点评 本题考查化学键的判断,为高频考点,把握离子键和共价键、配位键的形成为解答的关键,知道配位键的形成、氢键对物质溶解性的影响等知识点,题目难度不大.

练习册系列答案
相关题目
1.根据下表信息,判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的沸点为H2T<H2R | B. | 单质与稀盐酸反应的快慢为L<Q | ||
| C. | M与T形成的化合物是离子化合物 | D. | L2+与R2-的核外电子数相等 |
2.PM2.5是连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5试样的pH4.
(2)NOx 汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下: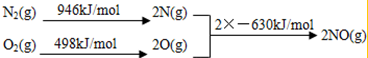
则N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下: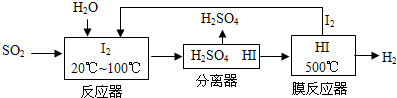
①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式H2-2e-+2OH-=2H2O
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳能}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.
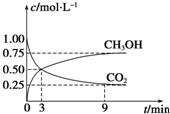
③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
(1)将PM2.5样本用蒸馏水处理制成待测试样.测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)NOx 汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

则N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应:SO2+I2+2H2O=SO42-+2I-+4H+
②将生成的氢气与氧气分别通入两个多孔惰性电极,KOH溶液作为电解质溶液,负极的电极反应式H2-2e-+2OH-=2H2O
(4)为了改善环境,中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%.
①有效“减碳”的手段之一是节能,下列制氢方法最节能的是C(填序号).
A.电解水制氢:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑B.高温使水分解制氢:2H2O(g)$\frac{\underline{\;高温\;}}{\;}$2H2+O2
C.太阳光催化分解水制氢:2H2O$\frac{\underline{\;\;\;TiO_{2}\;\;\;}}{太阳能}$2H2↑+O2↑
D.天然气制氢:CH4+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+3H2
②CO2可转化成有机物实现碳循环.在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ•mol-1,测得CO2和CH3OH(g)浓度随时间变化如图所示.从3min到9min,v(H2)=0.125mol•L-1•min-1.

③能说明上述反应达到平衡状态的是D(填编号).
A.反应中CO2与CH3OH的物质的量浓度之比为1:1
(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
④工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)?CH3OH(g)的平衡常数.下列说法正确的是AC.
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
B.该反应在低温下不能自发进行,高温下可自发进行
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2,达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高.
19.化学与科学、技术、社会、环境密切相关.下列说法不正确的是( )
| A. | 聚乙烯食品包装袋、食物保鲜膜都是无毒的高分子材料 | |
| B. | 高温能杀死流感病毒是因为构成病毒的蛋白质受热变性 | |
| C. | 太阳能电池板中的硅是硅单质,光导纤维的主要成分是二氧化硅 | |
| D. | 明矾[KAl(SO4)2•12H2O]常用于自来水的净化、杀菌消毒 |
6.X、Y、Z、R、W是短周期主族元素,X原子的最外层电子数是其次外层的2倍,Y是地壳中含量最高的元素,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和,W与Y属于同一主族.下列叙述正确的是( )
| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
16.下列说法中正确的是( )
| A. | 为防止食品氧化变质,食品袋中放有硅胶包 | |
| B. | 酒精用来杀菌消毒,利用了乙醇的氧化性 | |
| C. | 植物油与矿物油可以通过水解反应区分 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
20.下列除杂操作正确的是( )
| 物质 | 杂质 | 试剂 | 提纯方法 | |
| A | 苯 | 苯酚 | 溴水 | 过滤 |
| B | 二氧化碳 | 二氧化硫 | 饱和碳酸钠溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀氢氧化钠溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 蔗糖 | 饱和硫酸铵溶液 | 盐析、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
1.下列离子方程式书写正确的是( )
| A. | 澄清石灰水与少量小苏打溶液混合:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O | |
| B. | 磁性氧化铁溶于氢碘酸:Fe3O4+8HI=2Fe3++Fe2++4H2O+8I- | |
| C. | NaHSO4溶液中滴加过量的Ba(OH)2溶液:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 醋与氨水混合:CH3COOH+NH3?H2O=CH3COONH4+H2O |
 b.
b.